
«La que se avecina» es el título de la ponencia sobre el nuevo Reglamento, pero la geopolítica se ha colado y también podemos aplicarlo.
Hace unos días «tomé un café» en una sesión organizada por la casa comercial Dr. Weigert sobre el Reglamento 2017/745 (link de la noticia), del que ya hablé en el Blog en una entrada, pero esta vez lo voy a ampliar.

Me acompañó una amiga y profesional como Mercedes García Haro, que se centró en la aplicación directa en la RUMED. Fue de esas sesiones con amigos, en un ambiente muy distendido y agradable. Una organización inmejorable con el equipo de Dr. Weigert.

¿Qué debo hacer con el nuevo reglamento de productos sanitarios? (así se llamaba la charla). Leerlo y padecerlo en la intimidad como unas hemorroides.

Este reglamento tiene como objetivo garantizar la disponibilidad en el mercado de productos sanitarios eficaces, de calidad y seguros.

Reglamento de Productos Sanitarios o Medical Devices Regulation (MDR), son dos conceptos: Reglamento y Productos sanitarios (Artículo 2 del Reglamento 745/2017).

Los reglamentos son actos jurídicos que se aplican de manera automática y uniforme en todos los países de la UE desde su entrada en vigor, sin necesidad de incorporación al derecho nacional.
Son obligatorios, en todos sus elementos, en los Estados miembros. El Reglamento comunitario una norma de aplicación directa, el RD 1591/2009 ha pasado a quedar, en aquellos aspectos que no resulten conformes con aquel, desplazados (que no derogados). El Reglamento es una norma de aplicación directa, pero se supedita algunos aspectos o cuestiones a la regulación que se establezca a nivel nacional. El Reglamento obliga a:
1.- Derogar el Real Decreto 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios (excepto 21, 38, 39 y 40, y el Real Decreto 1616/2009, de 26 de octubre, por el que se regulan los productos sanitarios implantables activos (excepto 18, 34, 35 y 36), ante la aplicación directa del Reglamento (UE) 2017/745.
2.- Desarrollar las medidas reglamentarias necesarias para aquellos aspectos en los que el reglamento comunitario ha determinado que serán los Estados miembros lo que establecerán la regulación a nivel nacional.
3.- Adaptar, adoptar o mantener las medidas requeridas por la legislación nacional.
El futuro Real Decreto es necesario para establecer:
a) Los requisitos y procedimientos para la regulación de los productos fabricados y utilizados en un centro sanitario (fabricación in house)
b) Los requisitos y procedimientos para la regulación del reprocesamiento de productos sanitarios de un solo uso
c) La regulación de la tarjeta de implantación
d) La creación de un registro nacional de comercialización de productos sanitarios
e) Establecer que la autoridad competente es la Agencia Española de Medicamentos y Productos Sanitarios independientemente de las competencias de otras autoridades sanitarias
Según el proyecto de Real Decreto: Todas las centrales de esterilización o RUMED de los hospitales (públicos y privados) tendrán que obtener la Licencia de Funcionamiento.
¿Qué es un producto sanitario? Producto sanitario (Medical Devices: MD) es cualquier instrumento, dispositivo, equipo, programa informático, implante, reactivo, material u otro artículo destinado por el fabricante a ser utilizado en seres humanos y que no ejerce su acción principal prevista en el interior o en la superficie del cuerpo humano por mecanismos farmacológicos, inmunológicos ni metabólicos, pero a cuya función puedan contribuir tales mecanismos.
También se considerarán productos sanitarios los productos de control o apoyo a la concepción. Y atención, los productos destinados específicamente a la limpieza, desinfección y esterilización de los productos sanitarios. Se excluyen las lentes de contacto y productos para introducirse o colocarse en los ojos, y los productos invasivos quirúrgicos para modificar anatomía o fijación partes del cuerpo, excluidos tatuajes y piercings.
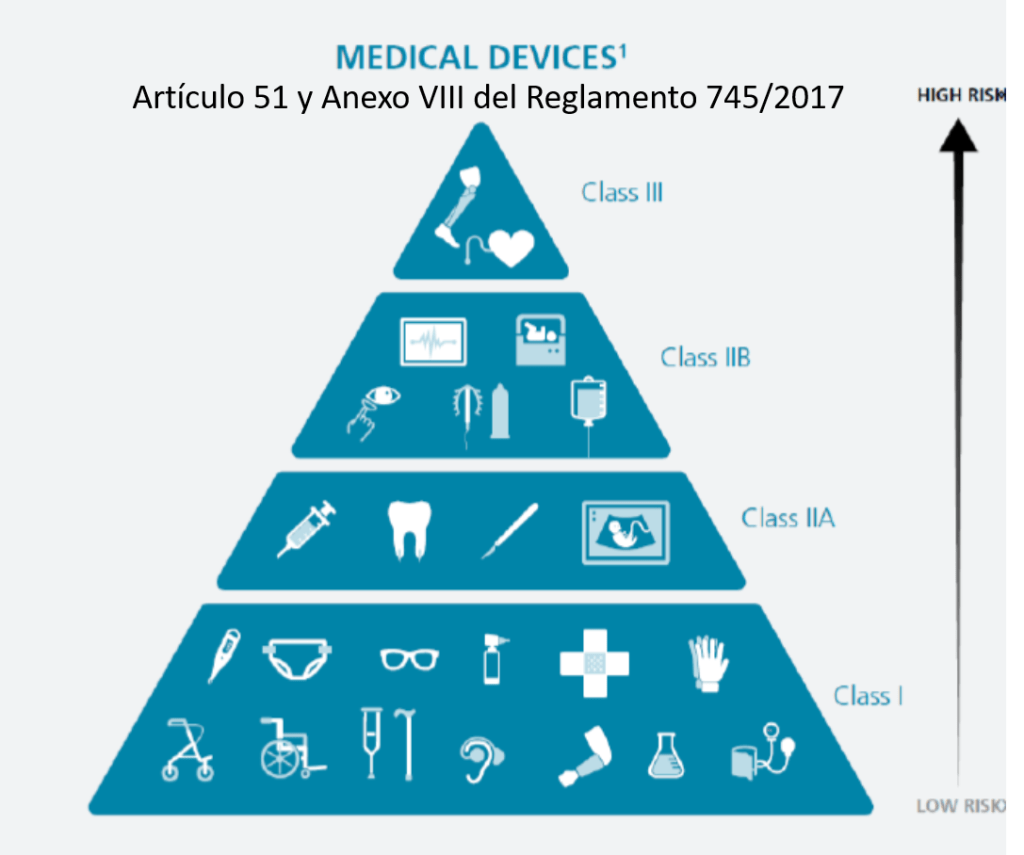
¿Cómo se clasifican los productos sanitarios? (Artículo 51 y Anexo VIII del Reglamento 745/2017)
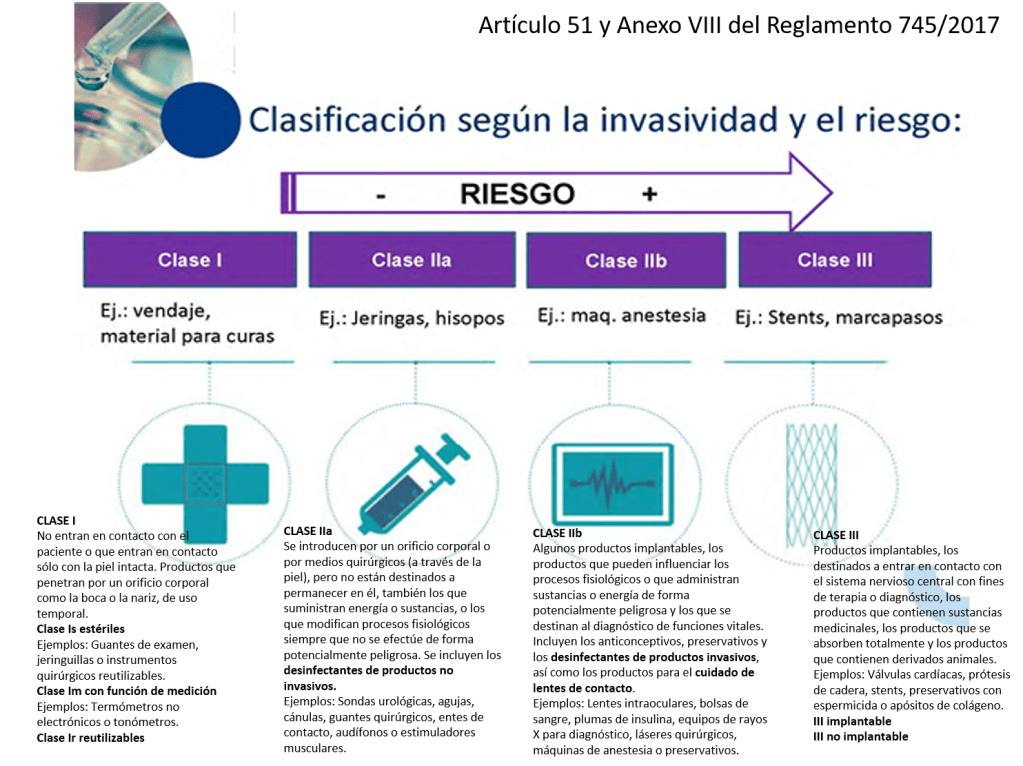

Este reglamento tiene unos cambios relevantes que se aplican a la Central de Esterilización o RUMED:
•Los desinfectantes de productos no invasivos son IIa
•Los desinfectantes de productos invasivos son IIb
•Las lavadoras desinfectadoras pasan a ser productos sanitarios de la clase IIb
•Los equipos de esterilización pasan a ser productos sanitarios de la clase IIa
•Los indicadores químicos y biológicos NO tienen la consideración de productos sanitario (Confirmado por la AEMPS que se lo ha dicho a un amigo). La empresa GKE ha elaborado un documento donde dicen que «The GKE cleaning process monitoring indicators (CPI) are no medical devices in all countries and do not require any registration» (Párrafo actualizado 21/04/2022).


•Los productos fabricados por el propio hospital para uso interno (in house) pasan a estar regulados y precisan de documentación técnica y sistema de calidad ISO 13485 (¡¡no la 9001!!).
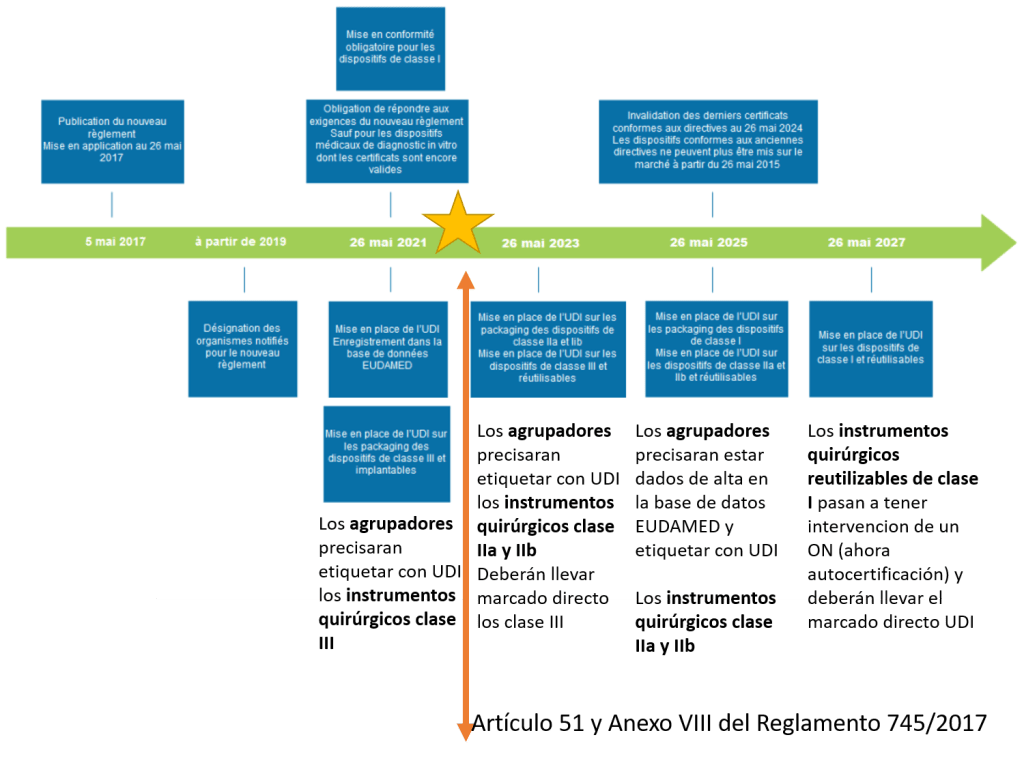
Aunque el Reglamento 2017/745 es de aplicación directa, hay determinados aspectos como el reprocesamiento, el régimen lingüístico o cuestiones de la fabricación en centros sanitarios, entre otros, que el reglamento determina que serán los Estados miembros los que establecerán la regulación a nivel nacional. Es por esto que en la actualidad se está elaborando el nuevo Real Decreto de Productos Sanitarios (sustituye al RD 1591/2009). Un producto sanitario:
-Se utiliza en personas.
–Finalidad prevista: Se diseña para cumplir un determinado fin. Documentada en el expediente técnico
-El fabricante lo ha validado en relación con el objetivo perseguido. Este objetivo lo establece el fabricante, y él mismo lo confirma, para emplearlo en relación con la enfermedad, discapacidad, proceso fisiológico, o patológico.
-Se ha diseñado para conseguir unos beneficios clínicos, siempre superiores a los posibles riesgos, y que él mismo ha sido capaz de evidenciar y justificar.
•Cuando se introduce un producto en el mercado, o lo pone en servicio, el fabricante se asegurará que se ha diseñado y fabricado con arreglo a los requisitos generales de producto sanitario.
•Realizar una evaluación clínica en relación con los requisitos esenciales de producto, incluyendo un seguimiento postcomercialización.
•Los de aquellos productos que no sean a medida, elaborarán y actualizarán la documentación técnica de dichos productos, permitiendo la evaluación de la conformidad de producto.
•Cumplir con las obligaciones de identificación y las de registro.
¿Cómo lo valida el fabricante? ¿Cómo el fabricante es capaz de determinar que, ciertamente, es capaz de ser eficaz y seguro para lo que él mismo pretendía Mediante el ejercicio de la evaluación clínica. La evaluación clínica es un proceso continuo, sistemático y planificado que pretende conseguir, evaluar y analizar información clínica. Estas normas pueden sernos de ayuda:

Y todo ello, en un sistema de seguridad y funcionamiento, que deberá disponer de un sistema de gestión de la calidad (UNE-EN ISO 13485 y la Guía o ayuda la UNE 179003:2009) y establecer, documentar, aplicar y mantener un sistema de gestión de riesgos (UNE-EN ISO 14971). Los estados miembros pueden permitir a los hospitales no aplicar todos los requisitos si la seguridad del nuevo producto son similares a las de los productos originales, el reprocesado se hace según especificaciones comunes sobre gestión de riesgos, la validación de procedimientos, liberación paramétrica o no de productos, ensayos, sistemas de calidad, etc… Solo se reprocesarán productos que se considere seguro hacerlo (por eso van a obligar a los hospitales obtener una Licencia de Funcionamiento). Los estados miembro pueden aplicar estas excepciones también a productos que se reprocesan en empresas externas a los hospital (PERO el producto vuelve al mismo hospital). Parece que los centros sanitarios y los fabricantes externos tendrán un régimen especial. Se abre la posibilidad a los «third party», aunque cada país puede imponer limitaciones al reprocesado y el uso de productos reprocesados. El reprocesamiento se lleva a cabo según especificaciones comunes sobre gestión de riesgos, validación de los procedimientos, liberación, sistema de gestión de la calidad, notificación de incidentes, trazabilidad.
En cuanto a los recursos humanos, se insiste en la figura del Responsable o Director Técnico, con unas funciones que ya conocemos:
•Supervisar las actividades de fabricación.
•Comprobar que se cumplen los requisitos exigidos por la reglamentación.
•Supervisar el archivo documental.
•Revisar y evaluar los incidentes.
•Ser interlocutor con las autoridades sanitarias y facilitar la documentación requerida.
•Solicitar la Licencia de Funcionamiento
Y aparece una nueva figura, que es el Responsable del cumplimiento del Reglamento (Artículo 15 Reglamento 745/2017), que tendrá esta formación, como Licenciado o Grado en Derecho, Medicina, Farmacia, Ingeniería u otra pertinente y un año experiencia en asuntos reglamentarios o SGC de productos sanitarios o cuatro de experiencia en asuntos reglamentarios o en SGC de productos sanitarios.
¿Y con todo esto ya vale?

Pues no, aun tenemos que (Artículo 10 del Reglamento 745/2017):
•Mantener a disposición de las Autoridades la documentación, la declaración de conformidad durante un periodo mínimo de 10 años desde la puesta en el mercado del último producto (15 años si son implantables).
•Disponer de un sistema de registro e información a las autoridades ante incidentes graves o acciones correctivas.
•A petición de la Autoridad competente, facilitarle toda la información para demostrar la conformidad de producto.
•En caso de que el fabricante encomiende a un tercero el diseño o fabricación del producto, se recogerá en la documentación.
•Las personas físicas o jurídicas podrán reclamar indemnizaciones por daños o perjuicios causados por un producto defectuoso; con arreglo al derecho nacional, o de la Unión, aplicable.
•Creación de una nueva base de datos llamada EUDAMED (acceso a las autoridades, la industria, los profesionales sanitarios y el público general) (Artículo 27 y 28 del Reglamento 745/2017 y Anexo VI).
•Mejora en la trazabilidad de los productos sanitarios, mediante la implantación de un número de identificación único (UDI) (Artículo 27 y 28 del Reglamento 745/2017 y Anexo VI).

Y una de las novedades es que se abre la posibilidad de regular a nivel nacional el reprocesamiento de productos de un solo uso. Los Estados miembros pueden aplicar las excepciones a productos de un solo uso que hayan sido reprocesados por un reprocesador externo a petición de un centro sanitario (Artículo 17 del Reglamento 745/2017).


Para terminar unas breves reflexiones en voz alta:
- Todo este Reglamento puede ser un revulsivo para las RUMED, por el papel central en la seguridad del paciente que se les da, pero ¿estarán todas preparadas? Yo creo que no. Algunos hospitales o centros pequeños no tiene personal cualificado suficiente, maquinaria y equipos validados, presupuesto para desarrollarlo…
- Creo que va a haber un boom de empresas especializadas en dar cobertura a todos los hospitales. Unos dando formación y asesoría en el Reglamento, sobre todo en los aspectos normativos, sistema de gestión de la calidad y sistema de gestión de riesgos.
- Y otras empresas dando servicios mediante subcontratación o externalización de la RUMED o de la Dirección Técnica y Normativa.
- No sabemos cómo será el futuro real decreto pero puede cambiar toda nuestra filosofía de trabajo.
Sé que es una entrada dura y con mucha información, y con muchas dudas que tendremos que ir solucionando.

El autor no tiene conflicto de intereses con la empresa Dr. Weigert
Y la despedida con uno de los mejores temas de los 70-80, con las Baccara y su «Yes Sir, I can Boogie» que se ha convertido en el himno no oficial de la selección escocesa de futbol, donde juega el petardo de Bale. En esos años, sólo sabían inglés Jesús Hermida y el Príncipe Gitano.






 Es un tema tratado en este Blog varias veces (
Es un tema tratado en este Blog varias veces (



Debe estar conectado para enviar un comentario.