Para saber la relación de Miguel Bosé con la entrada de productos de un solo uso, deberéis llegar al final de la entrada. No haré spoiler.
Ha costado, pero ha llegado el nuevo Real Decreto 192/2023, de 21 de marzo, por el que se regulan los productos sanitarios. Ya está publicado en el BOE, y ¡es gratis! nadie puede decir que no lo ha leído por no estar accesible. No es magia, son tus impuestos. Nos quejamos de que las normas UNE-EN ISO son de pago, y ahora tenemos 29 folios gratuitos y accesibles, y además te avisan si se cambia algo del reglamento con el paso de tiempo si estas suscrito a «Mi BOE».

Este Real Decreto viene a esclarecer algunas cosas que no había dejado escrito el Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, sobre los productos sanitarios, y del que ya hablé en este Blog.
Para no aburriros, lo que voy a hacer son pequeñas entradas de lo que me parece más importante que viene en este Real Decreto (Reglamento) que es de obligado cumplimiento en todo el territorio español (esto no entiende de autonomías) desde el 23 de marzo de 2023, día de San José Oriol. Haré entradas relativas a (este orden no es el de aparición en el Blog, si no que sigo el del reglamento):
- Definiciones y aspectos a tener en cuenta (Capítulo I del Real Decreto).
- Las Licencias de Funcionamiento (Capítulo II), que parece que sólo se va a pedir a las empresas que se dedican a reprocesar (empresas subcontratadas o externalizadas) o cuando un hospital sirve un producto a un hospital que no es de su grupo hospitalario (como los privados) o de su área sanitaria o un centro de centro de salud que no es de gerencia o área. Por supuesto, no puede esterilizar algo y dárselo a una clínica privada. Las licencias de funcionamiento serán necesarias en instalaciones a fabricantes, esterilizadores, agrupadores e importadores de producto sanitario y las instalaciones en que se lleven a cabo dichas actividades. Este requisito será también de aplicación a empresas que realicen un reprocesamiento de producto sanitario de un solo uso, fabricantes de productos sanitarios acogidos en el anexo XVI, aparatos e instrumental utilizados en el maquillaje permanente, semipermanente o en el tatuaje de la piel mediante técnicas invasivas y la fabricación completa de los productos para terceros.
- Fabricación por los hospitales de productos para su propio y exclusivo uso (Capítulo II) y los productos a medida (Capítulo II). ¿Quién no ha recibido ya alguna prótesis o producto metido en una bolsa con un folio y que se lo esterilicen? No se puede hacer si no es con unas condiciones que ya explicaré. Lo principal es que deberán realizar una comunicación previa, los `productos fabricados y utilizados en el mismo centro sanitario, los hospitales no podrán subcontratar ninguna de las actividades de fabricación, que no existan alternativas en el mercado. Y muy importante los productos de clase IIb, clase III e implantables no podrán ser objeto de fabricación por los hospitales. Y aquí viene algo que me llama la atención, tú puedes fabricar un producto de clase III en el hospital, pero si se considera producto a medida, el hospital solicitar una licencia previa de funcionamiento que será otorgada por las autoridades sanitarias de la Comunidad Autónoma donde resida. Esto me lo tienen que aclarar ¿podemos fabricar un IIb o III de resina y esterilizarlo en un hospital con una licencia de producto a medida?.
- Reprocesado de productos de un solo uso (Capítulo III), que es de lo que hablaré hoy.
- El Capítulo IV os interesa menos porque habla del Organismo notificado. Pero el Capítulo V si que interesa por que es el que trata la trazabilidad.
- Y nos quedarían el VI, VII, VIII y IX que haré un resumen.
Es importante decir que las definiciones de este reglamento ya venían en el reglamento europeo. A los efectos de este real decreto, se aplicarán las definiciones recogidas en el artículo 2 del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, sobre los productos sanitarios; por lo que no hay cambios. Pero me parece importante indicar que se incluyen:
- Los aparatos e instrumental utilizados en el maquillaje permanente, semipermanente o en el tatuaje de la piel mediante técnicas invasivas (Art. 3.1.b). Los tatuadores y maquilladores deberán cumplir las mismas normas que la central en cuanto a seguridad. Algo hablé del tema cuando hice la entrada del brote de tiña en las peluquerías y el virus del Monkeypox.
- Cuando un producto destinado por su fabricante a ser utilizado como equipo de protección individual esté destinado también a ser utilizado como producto sanitario deberá cumplir, además de la normativa aplicable a los productos de protección individual, las disposiciones de este real decreto (Art. 3.2).
La gran novedad de este reglamento es que ya se permite reprocesar productos de un solo uso. Y ya no podré cantar la canción de Camilo Sesto que tanto me gusta.

Lo he repetido mucho en este Blog que estaba prohibido reprocesa productos de un solo uso:
- Reesterilización de productos de un solo uso
- Los resectores de los bisturís eléctricos que son de un solo uso, no se reesterilizan
- Camilo Sesto en la esterilización de productos de un solo uso
- Se sigue sin poder reesterilizar productos de un solo uso… pero…

Y lo dice el título del Capítulo III «Reprocesamiento y nueva utilización de productos de un solo uso», habla del reprocesamiento y nueva utilización. Porque incido en lo de nueva utilización, por que mucha gente que me ha oído en foros, siempre hablo de la funcionalidad de los preservativos caducados en las carteras de los adolescentes de los años 80. Ahora tenemos que demostrar que el producto que reprocesamos funciona como si fuera nuevo. Eso no lo podemos hacer con los medios de nuestros hospitales.
En el año 2010 la Comisión Europea elaboró el Informe sobre el reprocesamiento de productos sanitarios en la Unión Europea que dice «Contrariamente a los productos sanitarios reutilizables, para los cuales se establecen requisitos en la Directiva 93/42/CEE a fin de garantizar una reutilización segura, en el caso de los productos sanitarios de un solo uso no puede afirmarse que su reutilización no presente riesgos desde el punto de vista de la salud pública. Además, también deberían tenerse en cuenta los aspectos éticos, económicos, medioambientales y relacionados con la responsabilidad del reprocesamiento de productos sanitarios de un solo uso, por lo que se analizan en mayor detalle en el presente informe».
«Los productos sanitarios de un solo uso, tales como agujas o catéteres de angioplastia, no están concebidos y diseñados para resistir a un procedimiento de reprocesamiento y el fabricante no necesita proporcionar ninguna instrucción o procedimiento validado para permitir un reprocesamiento seguro del producto, sino solamente información sobre las características o los factores técnicos conocidos por el fabricante que podrían presentar un riesgo en caso de que se reutilizara el producto. Por consiguiente, el reprocesamiento se realiza a partir de procedimientos elaborados por el usuario o el prestatario de servicios de reprocesamiento, pero sin información completa sobre el diseño y la composición del producto. Según un informe de los Países Bajos[16], la validación de un procedimiento de reprocesamiento para productos sanitarios de un solo uso, especialmente la limpieza, es una tarea que normalmente no puede realizarse en un hospital, ya que es poco probable que se disponga del equipo, el conocimiento, la experiencia y los recursos requeridos».
«No todos los productos sanitarios de un solo uso son adecuados para ser reprocesados debido a sus características o a la complejidad de determinados de estos productos. La posibilidad de reprocesamiento depende del material utilizado y de la forma del producto sanitario. Con el fin de identificar y reducir los peligros potenciales asociados con el reprocesamiento de un producto sanitario de un solo uso específico, debe evaluarse y validarse todo el ciclo de reprocesamiento que se inicia con la recogida de estos productos sanitarios de un solo uso después de su primera utilización hasta la fase final de esterilización y entrega, incluidas sus prestaciones funcionales.»

Así que el Reglamento permite reprocesa productos de un solo uso, pero NO SIGNIFICA BARRA LIBRE. Se puede hacer, pero siguiendo unas estrictas normas de calidad y seguridad «podrán llevarse a cabo siempre y cuando se cumplan los requisitos del presente real decreto» (Art. 11.1).
Los hospitales que lleven a cabo actividades de reprocesamiento deberán cumplir lo establecido en el artículo 17.3 del Reglamento (UE) 2017/745, que dice todo ésto:
- La gestión de riesgos: Tiene que existir un sistema. Para eso deberemos certificarnos (que es diferente a autorizarse y acreditarse) mediante alguna UNE-EN ISO como la UNE 179003 y la UNE-EN ISO 14971 (lo siento son de pago y no las puedo poner en el Blog, por que me llevarían a la cárcel). No quiero ser como Alexandra Elbakyan y su preciado sci-hub ¿Quién no lo ha utilizado alguna vez?
- Un sistema de gestión de la calidad como la UNE-EN ISO 13485 (que es la adaptación al producto sanitario de la 9001).
- En este tema de las UNE-EN ISO siempre puede ayudarnos (previo pago) una empresa certificadora, que generalmente les enseñas todo, les haces el trabajo y ellos dicen que haces las cosas como las describes en el manual (¡Viva los notarios del reino!). Ya sabéis lo poco que me gustan estos sistemas de auditoría por estas empresas con ánimo de lucro (incesante). Estos organismos que nos certifican deben realizarnos auditorías anuales (organismos acreditados para la certificación de sistemas de calidad de productos sanitarios) (Art. 13.5).
- Tener estos dos sistema de calidad y gestión de riesgos nos obliga a validar los equipos de limpieza y termodesinfección, las selladoras y los autoclaves (frío y vapor), además de los residuos que se producen en los dispositivos médicos. TODOS. Y las validaciones cuestan mucho dinero y esfuerzo.
- Trazabilidad: Eso al menos ya lo hacemos la gran mayoría de centrales o RUMED.
- Notificar incidentes.
- Y deberemos asegurarnos que funciona igual que antes. La funcionalidad es muy importante, y demostrarla muy difícil.
En conclusión. Los hospitales solo podrán reprocesar productos que hayan sido utilizados y reprocesados en su hospital o por un reprocesador externo incluido en su licencia. Los hospitales no podrán vender ni entregar el producto reprocesado a terceros (Art. 13.2 y 13.3).
Los hospitales podrán subcontratar las actividades de reprocesamiento a un reprocesador externo (Art. 14). OJO con estas empresas, ya que deben tener su domicilio social e instalaciones establecidas en España. Vamos que no se puede reprocesar en China o Pakistán (por ejemplo), si no que deben tener su domicilio en algún lugar del territorio español (por ejemplo en Quismondo o Pelahustán, que no son repúblicas exsocialistas soviéticas. Existen). Los reprocesadores externos deberán cumplir toda la normativa y no pueden subcontratar las actividades de reprocesamiento.

Y hay dos hechos que me parecen novedosos (Art. 15):
- «Los hospitales deberán informar a los pacientes de la utilización en su hospital de productos reprocesados por su propio centro». A partir de ahora se debe informar al paciente y reflejarlo en su historia clínica.
- Los productos reprocesados únicamente podrán utilizarse en los hospitales en un único paciente y durante un único proceso. Ya no vale reprocesar continuamente y a lo loco.
Una de las ventajas de permitir el reprocesado de productos de un un solo uso, sería reducir la huella de carbono de nuestros hospitales. Es un tema estudiado con los catéteres cardiológicos y catéteres de ablación, o intervenciones como las cataratas.

Cada vez serán más frecuentes los estudios de huella de carbono en hospitales o el bloque quirúrgico, endoscopias, y estudiar maneras de reducirla como la reutilización, reuso y reciclado. Quizás el medioambiente sea un motivo (y muy importante) de reprocesar productos de un solo uso .


Hay una serie de productos sanitarios que no se podrán reprocesar (Art. 11.2):
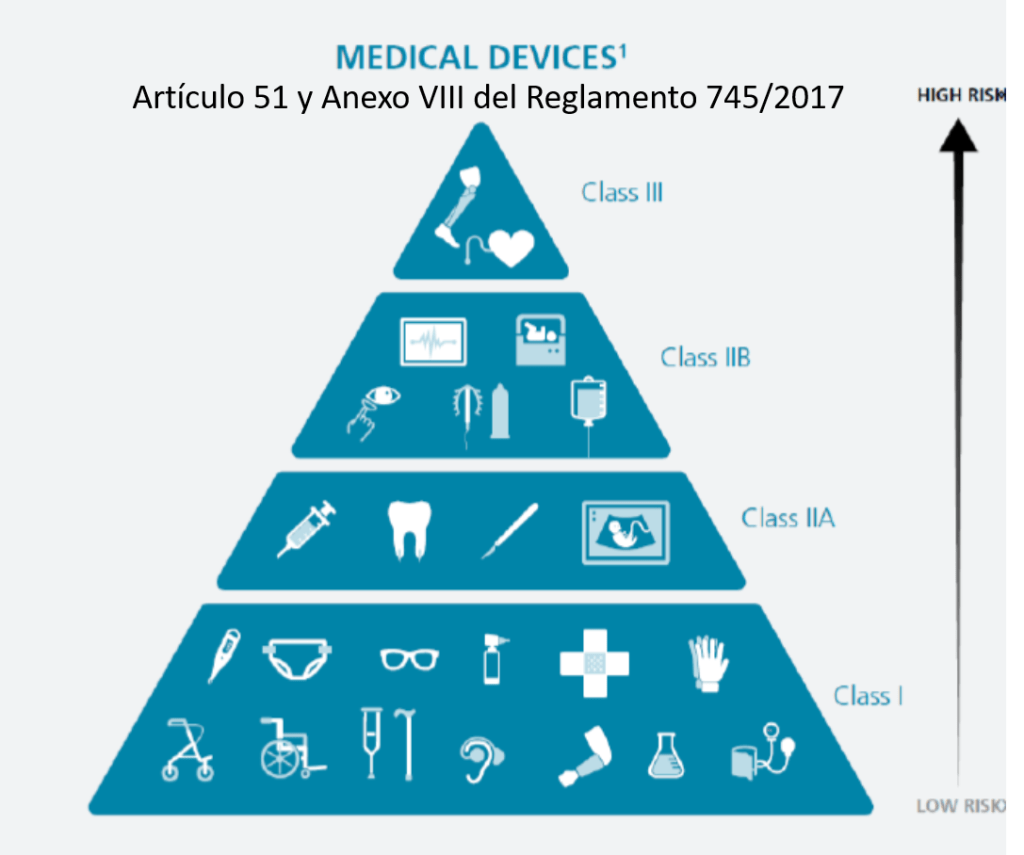
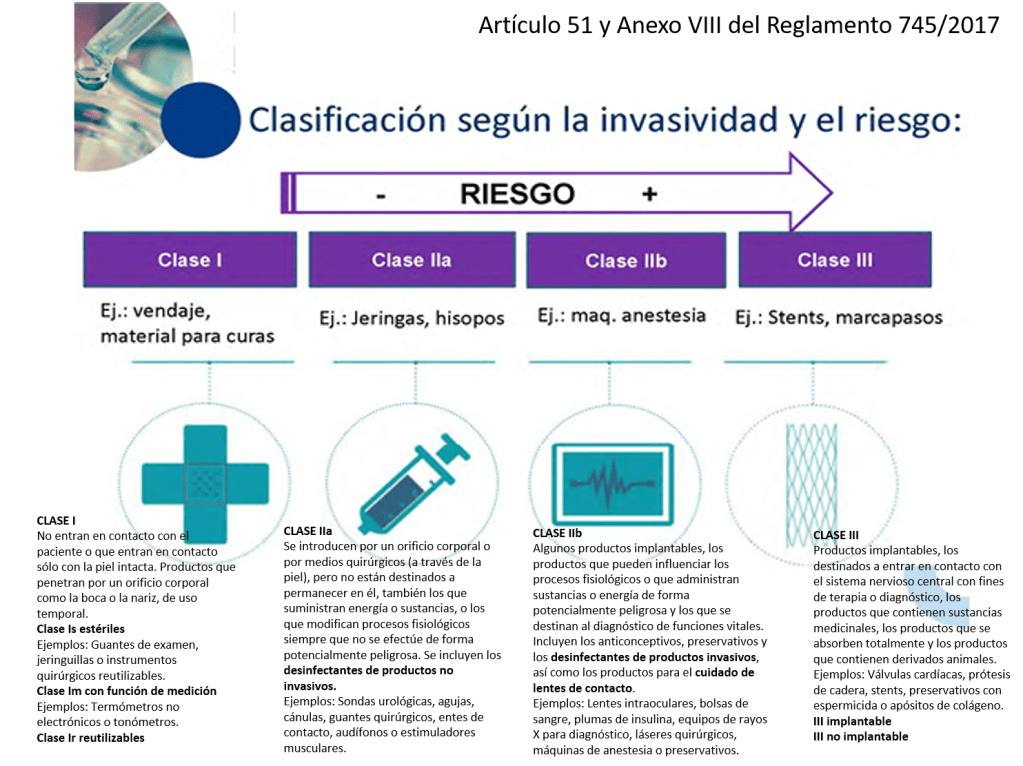
a) De clase I. Por ejemplo, bolsas de orina, vendas, medias elásticas, andadores, bastones y enemas, guantes de examen estériles, jeringuillas, gasas estériles para proteger heridas, tonómetros o termómetros no electrónicos.
b) A medida. OJO CON ÉSTOS
c) Fabricados y utilizados exclusivamente en hospitales de acuerdo con lo establecido en el artículo 5.5 del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017.
d) Que emitan radiación.
e) Utilizados para la administración de medicamentos citostáticos o radiofármacos.
f) Que incorporen sustancias medicinales.
g) Para uso en procedimientos invasivos en el sistema nervioso central.
h) Que presenten un riesgo de transmisión de encefalopatías espongiformes.
i) Implantables. OJO CON ÉSTOS, se definen como todo producto, incluidos los que son absorbidos parcial o totalmente, que se destina a ser introducido totalmente en el cuerpo humano o sustituir una superficie epitelial o la superficie ocular, mediante intervención médica, y a permanecer en su lugar después de la intervención. Se considerará asimismo producto implantable todo producto destinado a ser introducido parcialmente en el cuerpo humano mediante intervención médica y a permanecer en su lugar después de dicha intervención durante un período de al menos treinta días.
j) Relacionados con incidentes graves ocurridos tras el reprocesamiento cuya causa esté relacionada con el reprocesamiento, o para los que no pueda excluirse que la causa esté relacionada con el reprocesamiento.
k) Que tengan baterías que no puedan cambiarse o que presenten un riesgo de mal funcionamiento tras el reprocesamiento.
l) Que dispongan de un almacenamiento interno de datos necesario para el uso del producto y que no pueda cambiarse o presente un riesgo de mal funcionamiento tras el reprocesamiento.
m) Con hojas cortantes o que raspen, taladros o componentes que se desgasten que dejen de ser adecuados después del primer uso y que no puedan cambiarse o afilarse antes del siguiente procedimiento médico. OJO CON ÉSTOS, ¿COMO SABEMOS QUE LAS HOJAS NO ESTÁN AFILADAS EN UN HOSPITAL?
Así que ya sabéis, si os traen algo a reprocesar que es de un solo uso, o que se ha caducado en el almacén, o que se ha abierto por error y no se ha usado, SOLO PODÉIS REPROCESARLO SI TENÉIS LO INDICADO MÁS ARRIBA.
Y ya no es como antes, que el cirujano o traumatólogo de turno (en plan torero) te firmaba un documento, y se hacía responsable o que tu transferías la responsabilidad. Eso se ha acabado.
No os pringuéis y no os metáis en líos por no «cuadraros», de lo contrario os veréis ante un juez.
Y para torero, ahí está Luis Miguel Dominguín (que era del pueblo de mis padres y abuelos, y padre de una saga de artistas).
¿Ya no podré seguir oyendo a Camilo Sesto? Pues a partir de ahora cantaré la canción de Marta Sánchez «Desesperada».



































Debe estar conectado para enviar un comentario.