Recupero una entrada del año 2018 (hace 6 años), pero es que me han preguntado por el tema, y me he dado cuenta que tenía esta entrada y no la había actualizado. En cuanto al tema limpieza, desinfección y esterilización, hay poco o nada nuevo sobre el tratamiento de material potencialmente contaminado por priones. Mantenemos las normas ya publicadas por el CEDEST del año 1998 (¡hace 26 años!), en especial, las referentes a limpieza y termodesinfección.
Destaco la importancia de la limpieza en equipos de neurocirugía (Reducing the risk of iatrogenic CJD by improving the cleaning of neurosurgical instruments), que nos vuelve a recordar la importancia de esta fase del ciclo y del uso de lavados automáticos; y que el riesgo de transmisión quirúrgica existe si no hacemos bien nuestro trabajo (Iatrogenic Creutzfeldt-Jakob disease via surgical instruments). No nos podemos permitir mantener todo el instrumental en cuarentena como hacen en Suiza, por la escasez endémica del mismo que sufren nuestros hospitales, pero si al menos debemos velar por la calidad y la seguridad.
Quizás recordar cosas muy básicas y obvias, tomado del Blog de Matachana:
«Algunos países han implementado regulaciones específicas para garantizar la eliminación o inactivación de las proteínas priónicas de los dispositivos médicos. Todas ellas se basan en la detección de los pacientes de riesgo (confirmados, sintomatológicos o con condicionantes genéticos) y la atención específica de las cirugías relacionadas con el Sistema Nervioso Central (tejidos de alto riesgo): cerebro, médula espinal o parte posterior del ojo. Mostramos algunos ejemplos básicos:
- Siempre que sea posible, utilizar dispositivos sanitarios de un solo uso.
- Si no es posible, el dispositivo médico debe permanecer retenido/ en cuarentena hasta que pueda confirmarse la ausencia de riesgo, o destruirse en caso de confirmarse su contaminación.
- Utilización de procesos que experimentalmente hayan mostrado la capacidad de inactivar el prión, destruyendo la proteína».
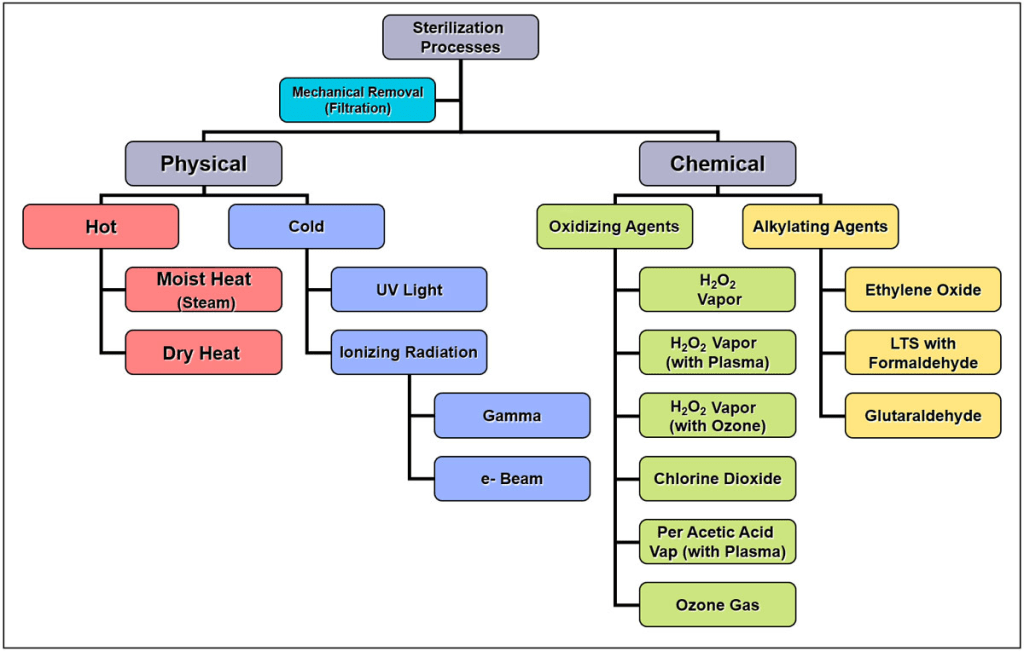
Es cierto que han aparecido en este tiempo nuevos sistemas de esterilización (como los peróxidos en diferentes equipos, además del peracético por inmersión), y que se mantienen las incompatibilidades con el formaldehído y el óxido de etileno. Pero lo más importante es la fase de limpieza y la termodesinfección, de nada sirve tener un equipo que esterilize si previamente no ha habido una limpieza correcta. «Los ciclos de vapor a 134 °C / 18 minutos, poseen una gran eficacia, aunque la inactivación puede no ser completa. Por ello, se recomienda el uso de una etapa de limpieza alcalina previa para instrumental utilizado en tejidos de riesgo.
Algunos métodos de esterilización, limpieza y desinfección pueden favorecer la fijación proteica sobre las superficies de los instrumentos quirúrgicos: alcohol, glutaraldehído, calor seco, óxido de etileno u otros agentes esterilizantes de tipo aldehídico. Los países con reglamentación específica sobre priones pueden desaconsejar el uso de estos métodos o exigir un procedimiento previo, no fijador, antes de aplicar esas tecnologías, por ejemplo, el uso de detergentes alcalinos de alto pH donde el fabricante declare su capacidad inactivante» (tomado del Blog de Matachana). Este es uno de los motivos por los que no se utiliza el vapor de formaldehído a baja temperatura (LTSF) en países como Francia o Suiza (pero si en otros como Alemania, Japón o España).
Aquí dejo una serie de documentos y enlaces sobre la materia:
Manuel completo FISCAM (Ver su anexo I)
Guia Comunidad Autónoma de Madrid de Infección Nosocomial (página 116 y 131)
Guía de recomendaciones de prevención y control de las EETH
Guía del Ministerio de Sanidad
Endoscopia y EETH. Si fuera preciso, quizás esté indicado usar equipos de un solo uso. «Hasta la fecha, no se han descrito casos de transmisión priónica a través de los endoscopios flexibles. Incluso el reprocesado parcial automatizado (solo limpieza) de los endoscopios reduce drásticamente los residuos de proteínas».
Como decía este artículo de 2006: «Los diferentes procedimientos invasivos siguen presentando un bajo riesgo de transmisión yatrogénica, …. Sin embargo, … la aplicación de métodos de desinfección mejorados sigue siendo una gran prioridad para aumentar las medidas de control ya existentes. Varios métodos de desinfección han mostrado potencial para su aplicación clínica. Los que finalmente se adopten serán probablemente los que tengan una eficacia sólida y puedan implantarse en los flujos de trabajo existentes de forma sencilla y segura, con un coste adicional y un impacto medioambiental mínimos. Teniendo en cuenta la advertencia de que se necesita urgentemente estandarización y orientación…».»
Y como despedida, una música de los más «bizarro» y extraño, los grandes Tip y Coll en su estado catártico:
Vale, pongo algo más normal, ya sabéis lo que me gusta la música francesa de los años 60 y 70:
















Debe estar conectado para enviar un comentario.