📢 Lanzamos la Revista de la SEDE
Hoy es un día muy especial para la SEDE. La semana pasada, presentamos con orgullo el primer número de la Revista de la SEDE a los socios, un nuevo espacio de divulgación científica y profesional dedicado a la desinfección, la esterilización hospitalaria y la prevención de las IRAS.
🗓️ Periodicidad trimestral
📖 Acceso totalmente gratuito
🎯Orientada a profesionales sanitarios, servicios de esterilización, calidad y seguridad del paciente
La revista nace con el objetivo de compartir conocimiento basado en la evidencia, promover buenas prácticas hospitalarias y contribuir a una atención sanitaria más segura y de mayor calidad.
👉 Os animamos a difundir este primer número y a acompañarnos en este proyecto colectivo. Divulgar conocimiento es clave para mejorar la práctica clínica y proteger a los pacientes.
🙏 Agradecimiento especial a Nelson Carreras Segura, director y coordinador de la revista, por su liderazgo y compromiso, así como a todas las personas que han participado en esta Edición 1 haciendo posible este ilusionante comienzo, inicio de un gran reto.
📌 Ya disponible:
https://lnkd.in/ecVB_ssy
Autor: JJ Criado-Alvarez
La sala de esterilización: seguridad y eficiencia en la odontología moderna

Las salas de esterilización no son exclusivas de los grandes centros sanitarios. También existen los «pequeños usuarios», a los que se les debe exigir cumplir las mismas normas, como pueden ser odontólogos, podólogos, centros de estética, veterinaria…
Para esta entrada cuento con la ayuda de Euronda.

La sala de esterilización es el núcleo de la seguridad en cualquier clínica dental. Aunque no siempre es visible, de su correcto funcionamiento depende la protección del paciente, del equipo clínico y la calidad asistencial del centro.
Un diseño eficiente, basado en la separación de zonas de limpieza, empaquetado y esterilización, permite un flujo de trabajo unidireccional que evita contaminaciones cruzadas y facilita el cumplimiento de las normativas europeas más exigentes. Esta organización no solo mejora la seguridad, sino que optimiza tiempos y recursos en el día a día de la clínica.
En este contexto, la experiencia y el enfoque técnico desarrollados en el ámbito de la esterilización han contribuido a consolidar una visión de la sala de esterilización como un espacio estratégico, donde la tecnología, la ergonomía y el control del proceso se integran de forma natural.
Más allá de la normativa, una sala de esterilización bien concebida refleja una auténtica cultura de calidad y un compromiso real con la odontología moderna y segura.

Aprovecho esta entrada para recordaros el Estudio que estamos realizando sobre Reprocesado de Materiales Sanitarios en punto de uso de centros sanitarios en España.

Y como la empresa que me ha ayudado en la entrada tiene origen italiano, pues me despido con música de ese país.

¿Podemos procesar un implante que venga con IFU («instructions for users»)?

Esta duda se planteó en el II Curso de Reprocesado de Instrumental Médico realizado en Oviedo del 6 al 8 de noviembre de 2005. Gracias a Jorge y Mamen por la excelente organización. Este curso tiene mucho futuro.

Sé que me estoy metiendo en un buen «freago», pero es que es un campo en continuo desarrollo y tenemos que ir aclarando conceptos. Además, esta es la entrada 300 del Blog y hay que meterse en temas controvertidos.
El RD 192/2023 regula los productos sanitarios de uso humano en España, incluyendo sus accesorios, y hará de acompañamiento al Reglamento (UE) 2017/745 (“MDR”) que es de aplicación directa en la UE.
Si un hospital recibe un implante de tipo IIb o III (alto riesgo, como prótesis cardíacas, implantes neurológicos, implantes óseos, dispositivos vasculares, entre otros), y el fabricante proporciona en las IFU (Instrucciones de Uso o para el usuario final) procedimientos específicos de limpieza, reprocesamiento y esterilización, es fundamental cumplir con una serie de consideraciones técnicas y regulatorias obligatorias:
1. Validación del proceso por parte del fabricante
El proceso descrito en la IFU debe haber sido validado por el fabricante. Esto implica que el fabricante ha demostrado, mediante estudios documentados, que el reprocesamiento no compromete la seguridad, la funcionalidad ni la biocompatibilidad del dispositivo. El hospital solo podrá realizar la limpieza o esterilización conforme a esas instrucciones validadas.
Su uso está previsto una sola vez (single use), salvo indicación contraria explícita y validada por el fabricante. Y que quiere decir ésto, pues que si se te infecta o se complica la cosa, no vale con quitarlo y que nosotros lo reprocesemos otra vez (OJO CON ÉSTO).
Y aquí pregunto: ¿tenemos validadas nuestras lavadoras termodesinfectadoras? ¿y nuestros autoclaves y esterilizadores? Pues, en general, NO. Entonces, ¿podemos asegurar al usuario final que el producto final que le entregamos va a ser como él lo espera? Si en al menos uno de los dos casos tu respuesta ha sido NO, entonces no te metas en este lío. Otro OJO, validar no es poner indicadores biológicos. Validar es certificar que un autoclave o un esterilizador cumple unas normas de validación establecidas previamente; y que debe realizar en la instalación una empresa que no puede coincidir con la empresa fabricante del equipo.
2. Cumplimiento estricto de las instrucciones
El establecimiento sanitario debe seguir de manera exacta todos los pasos indicados por el fabricante: tipo de detergente, método y parámetros de esterilización (temperatura, presión, tiempo, tipo de ciclo), tipo de envase o empaque, controles de esterilidad, etc. Cualquier desviación invalida la garantía del proceso y traslada la responsabilidad al hospital.
- El fabricante ha validado el proceso de reprocesamiento, incluyendo limpieza, desinfección y esterilización, y lo describe en la IFU.
- Tú (el hospital) sigues exactamente los pasos, parámetros y materiales especificados (p. ej., tipo de detergente, temperatura, método de esterilización).
- El fabricante asume la responsabilidad de que el dispositivo sigue siendo seguro y eficaz después del proceso, siempre que tú sigas sus instrucciones al pie de la letra.
👉 En este caso, el hospital no se convierte en “fabricante” ni asume responsabilidad adicional, ya que está actuando conforme al uso previsto y validado por el fabricante.

3. Responsabilidad del fabricante y del hospital
Mientras el hospital actúe conforme a las IFU, la responsabilidad de la seguridad del dispositivo tras el reprocesamiento recae en el fabricante. En cambio, si el hospital modifica el proceso, utiliza métodos no validados o reprocesa un dispositivo declarado de “un solo uso”, entonces asume el rol de fabricante según la legislación aplicable (p. ej., Reglamento (UE) 2017/745, artículo 17), con todas las obligaciones regulatorias asociadas.
Para productos implantables, el RD regula que junto al producto se debe entregar al paciente la “tarjeta de implante” que contenga información (por ejemplo: identificación del producto, número de lote, etc.). También se establecen obligaciones de registro nacional de implantes para que los centros y profesionales comuniquen datos.
4. Reprocesamiento de dispositivos de un solo uso
Los dispositivos marcados como “single use” no deben ser reprocesados ni reesterilizados. En el caso de implantes de clase IIb o III, el reprocesamiento está prohibido realizarlo (de momento), salvo que exista una autorización expresa y un proceso validado conforme a la normativa nacional o europea vigente.
5. Documentación y trazabilidad
Todo procedimiento de limpieza y esterilización debe estar documentado, trazable y controlado dentro del sistema de gestión de calidad del hospital.
Esto incluye:
- Registro de lote o número de serie del dispositivo.
- Identificación del personal responsable.
- Validación y control de los equipos de reprocesamiento.
- Verificación de los parámetros del ciclo de esterilización.
| Situación | ¿Se puede limpiar/esterilizar en el hospital? | Condición |
|---|---|---|
| IFU incluye instrucciones validadas por el fabricante | ✅ Sí | Siguiendo exactamente las instrucciones validadas |
| IFU indica “single use only” o no describe reprocesamiento | ❌ No | Sería un reprocesamiento no autorizado → el hospital pasa a ser “fabricante”. |
| Implante de tipo III sin validación del proceso | ❌ No | Riesgo alto, no permitido sin validación y certificación específica. |
La entrada publicada el 06/01/2026 está teniendo cierto eco, y he recibido un comentario de Xavier Canals de Tecnomed Ingenieros Consultores que añade información que puede ser útil para todos y copio textual en cursiva:
Solo unas consideraciones regulatorias…
«1. Validación del proceso por parte del fabricante»; si no estuviera validado, no le habrían dado el marcado CE. En caso de duda sobre el proceso, solicitar información adicional al fabricante.
Un único caso donde podríamos no tener esta información es en implantes que ya vienen estériles (lo más normal) o en los implantes a medida donde el fabricante es el propio hospital, por ejemplo. (hay que solicitarselo o … no usarlo.
» Validar es certificar que un autoclave o un esterilizador cumple unas normas de validación establecidas previamente; y que debe realizar en la instalación una empresa que no puede coincidir con la empresa fabricante del equipo.» Entiendo que la frase correcta es «y que puede no coincidir con la empresa fabricante del equipo»,
en general, el fabricante es el que tiene más facilidad de realizar la validación y, en su caso, reparar el equipo si no pasa la validación Debe incluir también una parte de la validación a nuestro servicio, procedimientos y registros… Imaginaros en un símil doméstico alguien que lavara prendas de color en el programa de la lavadora de algodón de 90 ºC… La lavadora, ok, pero el mal uso produce resultados defectuosos.
«4. Reprocesamiento de dispositivos de un solo uso
Los dispositivos marcados como “single use” no deben ser reprocesados ni reesterilizados. En el caso de implantes de clase IIb o III, el reprocesamiento está prohibido realizarlo (de momento), salvo que exista una autorización expresa y un proceso validado conforme a la normativa nacional o europea vigente.»
El reglamento MDR indica que, al no llegar a un acuerdo de todos los países europeos, cada país debía establecer su autorización. Para España, el RD 192/2023 establece que sí se pueden reprocesar productos sanitarios de un solo uso, pero que precisan licencia, segregando el caso de «fabricante de producto reprocesado» (art.12) del de «reprocesamiento en hospitales» (art.13) y sus subcontratistas «reprocesadores externos» (art.14)
Ahora solo está permitido el de los «fabricantes de producto reprocesado», y que no tengo conocimiento de que haya ninguno autorizado. Para los hospitales, según la disposición final tercera: » 2. Las actividades de reprocesamiento de productos de un solo uso en hospitales establecidas en el capítulo III, (incluida la subcontratación de estas actividades a un reprocesador externo) requerirán el previo desarrollo por el Ministerio de Sanidad de los requisitos técnicos establecidos en este real decreto», es decir, que hay que esperar a un decreto nuevo.
y hay que tener en cuenta que el RD 192/2023: «Artículo 15. Utilización de productos de un solo uso reprocesados. … 2. No se permitirá la adquisición y utilización en España de productos que hayan sido transferidos a un tercer país para su reprocesamiento…»
Colofón final, y respuesta a la pregunta de la entrada:
¿Es posible hacerlo legalmente en España? SI
¿Es probable que tengamos todos los elementos necesarios para hacerlo? NO
Conclusión: NO, al menos de momento.
Deseo que en el día de los Reyes Magos hayáis recibido muchos regalos y no estéis leyendo esta entrada en el Blog porque os han traído la corbata o los calcetines de todos los años. Yo tengo un nuevo estuche para mi trompeta.


Espero ayudar en lo que pueda con esta entrada. Se puede liar la cosa como el que montan «El canijo de Jerez» y «Los Estanques».
Para los que me pedís algo serio:
Feliz Navidad y próspero año 2026
Desde este modesto blog dedicado a uno de los temas más desconocidos que hay en el mundo sanitario, os quiero desear a todos una muy feliz Navidad y un mejor 2026.
Para poner en valor vuestro trabajo, voy a poner el vídeo de amigas. La Central de Esterilización es un pilar esencial en la seguridad hospitalaria. Su trabajo, silencioso pero vital, garantiza que cada instrumento utilizado en la atención sanitaria cumpla con los más altos estándares de higiene y calidad. Gracias a su rigor, compromiso y precisión, se protege la salud de pacientes y profesionales, asegurando la confianza en cada procedimiento quirúrgico. En la Central de Esterilización, cada detalle cuenta. Su labor invisible salva vidas visibles: la seguridad del hospital comienza en sus manos.
María Guedes nos presenta su central y su trabajo desde Burgos (España). ¡¡Creo que tengo que ir a Burgos un día!!
Y desde Paraguay nos presenta su central Gloria Gauto a la que conocí en Cartagena (Colombia). Como podéis ver, no importan las distancias todos trabajamos igual, y con el mismo propósito:
Os lo recuerdo todos los años, pero yo vuelvo a insistir. Si me queréis regalar algo, que sea una corbata, unos calcetines atrevidos o un reloj automático, que me encantan, que ya no sé decirlo más claro.


Para el Blog no ha sido un mal año; volvemos a las cifras de otros años, ya que 2020 fue excepcional con las entradas de la Reutilización y desinfección de mascarillas. Vamos camino de 1.600.000 visitas con 950.000 visitantes (no me lo esperaba hace 8 años), con una media de 15.000 palabras por entrada, que son en total 297 entradas a lo largo de estos años.
| Año | Vistas | Visitantes | Entradas |
| 2017 | 2.057 | 965 | 23 |
| 2018 | 41.737 | 26.154 | 50 |
| 2019 | 101.428 | 62.854 | 47 |
| 2020 | 615.116 | 455.558 | 36 |
| 2021 | 166.957 | 111.854 | 31 |
| 2022 | 171.315 | 112.450 | 33 |
| 2023 | 119.266 | 79.186 | 34 |
| 2024 | 105.606 | 65.126 | 21 |
| 2025 | 52.055 | 32.752 | 17 |
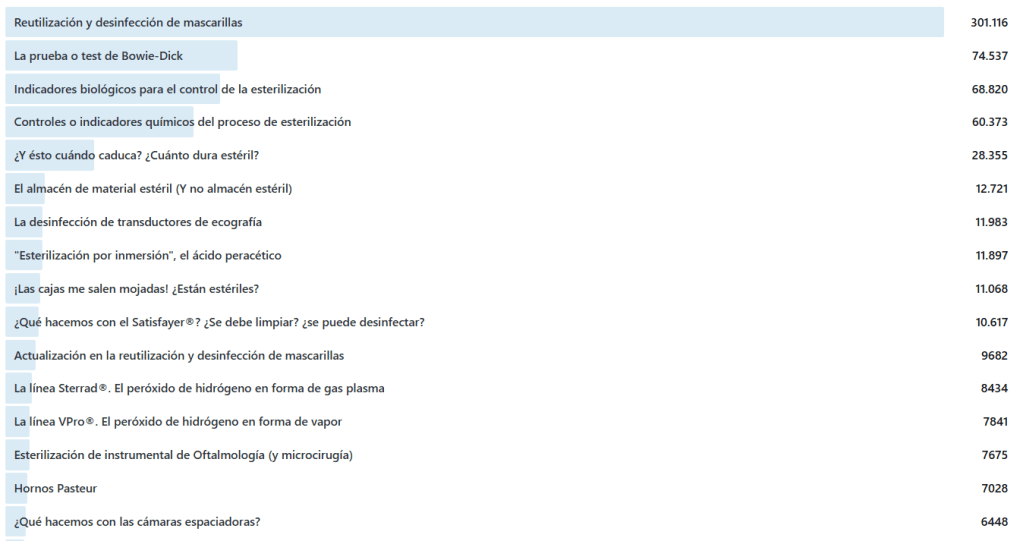
Aunque se han reducido las entradas, vistas y visitantes, hay un dato que me sorprende y es que han subido las vistas por visitante, es decir, que la gente vuelve a leer una entrada que ya había iniciado (quizás lo que escribo parece interesante). Se ha pasado de 1,50 en 2023 a 1,76 en 2025. ¿Y qué es lo más leído de este 2025? Sorprenderos:

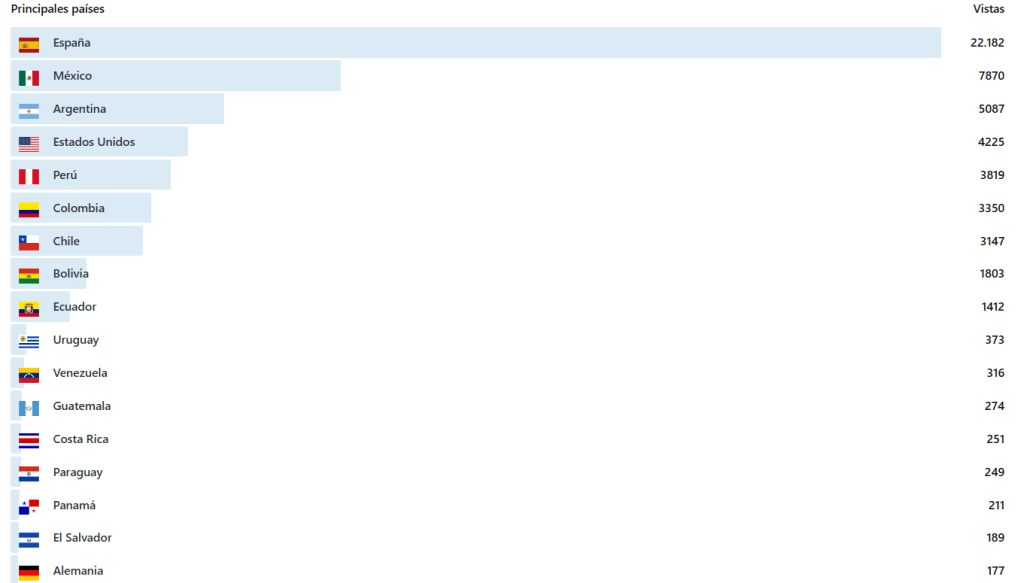
Y en los 8 años de vida del Blog:


La música final es The Pogues con una canción muy navideña, con su origen irlandés y estilo folk, punk y celtic que me encanta, y os pongo todos los años.
Os recuerdo dos propuestas de estudios que tenemos en marcha.
Os recuerdo el estudio que estoy desarrollando con Emi Sabuco sobre reporcesado en punto de uso.
Enlace: https://forms.office.com/e/86XFaF2kEv
Desde la Fundación FIDISP se ha puesto en marcha un estudio titulado “Seguridad microbiológica y Desinfección de Alto Nivel (DAN) en Oftalmología”, cuyo objetivo es conocer las prácticas actuales en la desinfección de alto nivel de dispositivos oftalmológicos reutilizables. La consulta está dirigida a profesionales de oftalmología, medicina preventiva, control de infecciones, esterilización, calidad y seguridad del paciente. Con las respuestas obtenidas, posteriormente llevaremos a cabo un ejercicio Delphi con expertos para elaborar un informe que sintetice los resultados y las recomendaciones derivadas.
La encuesta tiene una duración aproximada de 8–10 minutos y puede accederse aquí:
https://es.surveymonkey.com/r/NEWS_320
FELIZ NAVIDAD Y PRÓSPERO 2026
Desinfección ambiental «one touch» mediante oxidación ¿quitará el mal olor de pies?
En primer lugar quiero felicitar a nuestro colega y amigo Jorge de la Vega y su Equipo (enfermeras y TCAEs) que han recibido uno de los premios Best In Class 2025 al «Mejor Servicio de Esterilización/Reprocesamiento». También dar la enhorabuena a las otras centrales que participaban.




Os recuerdo el estudio que estamos desarrollando, y os solicito vuestra colaboración en su difusión. Gracias.
Enlace: https://forms.office.com/e/86XFaF2kEv
Los sistemas de desinfección «one touch» están avanzando con nuevas tecnologías (Nuevos productos en desinfección «No touch». Bioseguridad, bioprotección y bioética; La fotocatálisis y la luz UVC mediante LED como desinfectantes «No touch»,…) que hemos tratado en diferentes entradas de este blog.
Es cada vez mayor la publicación de artículos que demuestran que el uso de equipamiento de filtrado de aire puede ser útil para reducir la presencia de gérmenes en el aire. En este trabajo del Journal of Aerosol Science. Los investigadores recogieron muestras de aire de varias unidades y pasillos, encontrando partículas virales detectables especialmente en las clínicas y pasillos con pacientes. Sin embargo, las áreas con ventilación de presión negativa y filtros HEPA no mostraron virus en el aire, lo que confirma la alta eficacia de estas medidas para evitar la transmisión aérea en zonas críticas. El estudio demuestra que el uso de un purificador de aire específico en una habitación con pacientes COVID-19 redujo drásticamente la cantidad de ARN viral en el aire. Los filtros de partículas PM1 mostraron un 77,8% de positividad viral y los de PM2.5 un 38,5%, lo que evidencia que las partículas más finas pueden transportar el virus con mayor frecuencia. La instalación de un purificador de aire en una habitación COVID redujo la carga viral en el aire hasta en un 98,1%, demostrando que estos dispositivos pueden ser una herramienta clave para proteger a pacientes y personal sanitario.
Tenemos que decir que la detección de ARN viral no necesariamente implica presencia de virus viable o infeccioso, por lo que el riesgo real de contagio podría ser distinto, y que no se evaluaron otros factores ambientales o de comportamiento que podrían influir en la transmisión aérea, como la movilidad del personal o la apertura de ventanas. Este trabajo refuerza la importancia de la ventilación avanzada y el uso de purificadores de aire como barreras efectivas frente a la transmisión aérea de patógenos en hospitales.

Aprovechando este artículo que ha salido hace poco, hoy toca hablar en el blog de la tecnología de Nuvohla Med(R) basada en procesos de oxidación avanzada. Es una tecnología sin filtros y, de manera continua, limpia el aire y las superficies mediante la combinación de la evaporación de agua oxigenada (H202) al 17,5% y ozono ambiente; generando radicales de hidroxilo neutros (OH-). Con ello, se consigue reducir la contaminación ambiental de gases y sustancias químicas, olores, partículas PM (incluidas PM 0,3), así como la eliminación de virus, bacterias y hongos tanto en aire como en superficies.

El dispositivo Nuvohla Med biodescontamina el aire interior y las superficies del hospital, centro de salud o ambulancia, proporcionando un ambiente seguro para los pacientes y profesionales sanitarios.

Dispone de estudios de validación de la actividad antibacteriana y antifúngica, además de la desinfección y purificación del aire y de las superficies sin filtros.
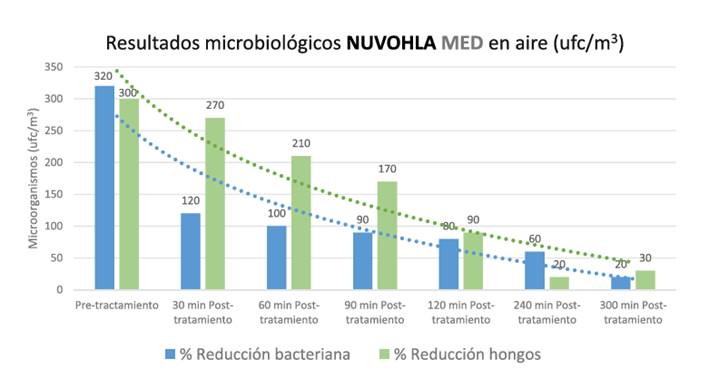

Ha mostrado una tasa de reducción del 93,75% para las bacterias aerobias totales y del 90% para los hongos ambientales después de 300 minutos de funcionamiento. También ha mostrado una tasa de reducción en superficies de plástico bacteriostáticas no porosas del 63,5% para las bacterias aerobias totales y del 47,3% para los hongos, después de 300 minutos de funcionamiento. Además, se ha observado una actividad antiviral en virus inoculados del 99,5% desde los 30 minutos, y una reducción del 33% en formaldehído (HCHO) después de 120 minutos de funcionamiento.
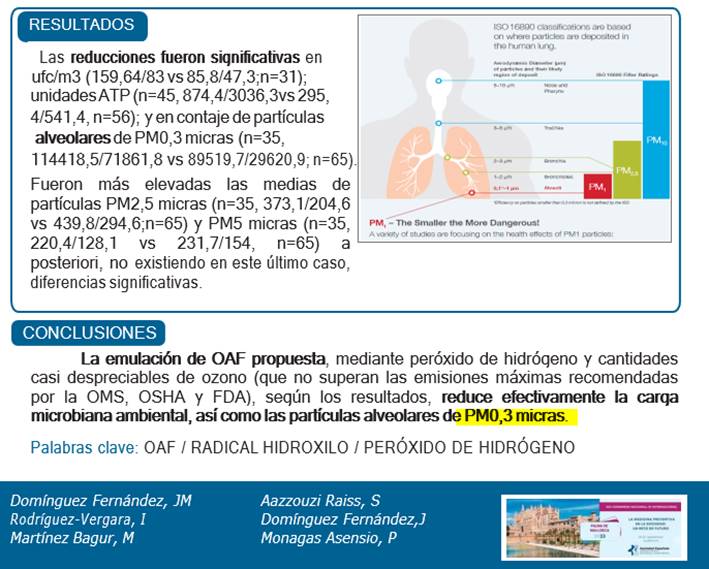
Esta tecnología fue presentada en el penúltimo Congreso de la SEMPSPGS celebrado en Palma de Mallorca y estas fueron las conclusiones del Estudio sobre el equipo Nuvohla Med realizado por el Hospital Universitario de Ceuta.
“Reduce efectivamente la carga microbiana ambiental, así como las partículas alveolares de PM 0,3 micras”


Conviene recordar que todas estas ayudas técnicas son elementos que nos ayudan a controlar la bioseguridad ambiental, pero que en ningún momento son sustitutos de la limpieza manual, sino un complemento. Son muchos productos y dispositivos, quizás ya ha llegado el momento de hacer una evaluación completa o una revisión sistemática sobre el tema.
Como siempre que hablo o comento productos de casas comerciales, quiero comentar que no tengo conflictos de intereses ni he recibido compensación económica o de otro tipo por esta entrada.
Desde los IgNobel 2025 proponemos una utilidad a los equipos «No touch», como es eliminar el mal olor de los zapatos. Una investigación india, donde el olor a pies figura como un problema nacional poco investigado, según los científicos, pese a que las condiciones climáticas de calor y humedad lo intensifican, ha revelado que a la mayoría de los 149 encuestados (54,6%) le molesta el olor a pies, aunque no desvela las razones del resto para no sentirse incómodo ante tal aroma. “Los zapatos rara vez se lavan y, sin una ventilación adecuada, se convierten en un caldo de cultivo para una bacteria muy maloliente llamada Kytococcus sedentarius”. La investigación analiza y propone soluciones para usar los muebles zapateros como centros de desactivación de esta arma química. (tomado de El País).
Este artículo o investigación le ha valido un premio en 2025 «Smelly Shoes – An Opportunity for Shoe Rack Re-design«. Cuando los medios tradicionales no funcionan:

Pues tendremos que usar alguno de los sistemas como el UVC:

Tenéis toda la información para quitar el olor de los pies en: Kumar, V., Mittal, S. (2022). Smelly Shoes—An Opportunity for Shoe Rack Re-Design. In: Muzammil, M., Khan, A.A., Hasan, F. (eds) Ergonomics for Improved Productivity. HWWE 2021. Design Science and Innovation. Springer, Singapore. https://doi.org/10.1007/978-981-16-2229-8_33
Así que la música de despedida será un popurrí de lo más variado, como pasa con estos dispositivos. O poneros a leer.
Y algo muy español como un pasodoble a un torero:
El uso de la IA en la configuración de cajas
NOTA DEL BLOG: Desde el 1 de noviembre de 2025 este Blog dejará de tener publicidad insertada por WordPress, lo que facilitará la lectura de las entradas.
🎧Cuando creías que ya lo sabías todo sobre esterilización… llega #SEDEOpina a desinfectar tus ideas 💡🧴😆
Primer episodio de “SEDE Opina»💡. La voz de los expertos en esterilización hospitalaria. La Sociedad Española de Desinfección y Esterilización (SEDE) lanza un nuevo episodio de su espacio “SEDE Opina”, un podcast dedicado a compartir conocimiento, experiencias y buenas prácticas sobre desinfección, esterilización y prevención de infecciones relacionadas con la asistencia sanitaria.
En este formato ágil y cercano, nuestros especialistas analizan los retos actuales en la seguridad del paciente, la gestión de centrales de esterilización y la implantación de normas internacionales (ISO 13485, ISO 17665, ISO 15883) en los entornos hospitalarios.
🎧 Escúchalo aquí: https://lnkd.in/dbTrzKrM 🔗 Descubre cómo la innovación y la formación continua fortalecen la calidad asistencial.
La Inteligencia Artificial (IA) ha llegado a la central de esterilización. En todos los congresos se habla de IA aplicada, si es un congreso de nefrología será la IA aplicada a nefrología, y si es un congreso de geriatría, pues habrá una ponencia o mesa redonda sobre utilidad de la IA en geriatría. En el II Congreso de SEDE pudimos ver una tecnología basada en IA y aplicada a la configuración de las cajas o contenedores. Nos lo enseñó la empresa HealthTech Innovations.

Se trata de una tecnología que te ayuda en la configuración de la caja y el sistema de trazabilidad que tengamos implantado en nuestra central (Trazins, Marvax…). Es un contador de instrumentos quirúrgicos impulsado por IA que mejora la precisión quirúrgica, reduce los riesgos y optimiza el quirófano y las unidades de esterilización. No requiere una gran infraestructura ni logística. Se trata de Medvision Pro.

Aunque es un software requiere de su marcado CE.

Se trata de una especie de lector que va leyendo, rastreando o escaneando el instrumental que tenemos en un tapiz o sobremesa, y nos va diciendo si ese instrumental pertenece o no a la caja o contenedor. Para ello, necesita escanear todas las cajas que tenemos en nuestros centros sanitarios. Eso puede ralentizar su implantación, además de que ya sabemos que determinadas cajas son configuradas a «gusto» del cirujano o las cajas de préstamo (itinerancia).

Lo mejor es verlo en un vídeo. Y aunque puede parecer que es un sistema que podría enlentecer, vi que una caja de unas 130 piezas se puede contabilizar y rastrear en 12 minutos. Personalmente creo que estos sistemas ayudan a la larga en nuestra seguridad en la central, e incluso como sistema de formación ya que permite ver errores de configuración, y así entrenar al personal de nuevo ingreso en la central.
Os aconsejo este artículo (en abierto) que ha salido «Deol, E.S., Henning, G., Basourakos, S. et al. Artificial intelligence model for automated surgical instrument detection and counting: an experimental proof-of-concept study»

Como siempre que hablo o comento productos de casas comerciales, quiero comentar que no tengo conflictos de intereses ni he recibido compensación económica o de otro tipo por esta entrada.
Os dejo unos minutos musicales un poco más tranquilos a lo que estáis acostumbrados conmigo.
Y ya que hablo del congreso, aquí os pongo unas fotos del mismo.




Y la música final va dedicada a Alberto y Daniel. Solo vosotros lo entenderéis si habéis llegado aquí.

Enlace: https://forms.office.com/e/86XFaF2kEv
Y aquí tenéis mi discurso de ingreso en la Real Academia de Medicina de Castilla-La Mancha como Académico de Número (nº 7).
Prácticas de bajo valor en el sistema sanitario
🔍 Un nuevo informe del Grupo de Expertos en Evaluación del Desempeño de los Sistemas de Salud (HSPA) de la Comisión Europea destaca la urgente necesidad de identificar, medir y reducir las prácticas sanitarias que no aportan valor real a los pacientes🏥💸. El informe, publicado en febrero de 2025, se basa en una revisión bibliográfica del estado de la cuestión y en los resultados de una encuesta realizada por el grupo de expertos en HSPA (si conseguís saber quiénes son los expertos, me lo decís, no consigo encontrarlos).
🚫 Estas intervenciones, conocidas como «low-value care», pueden:
❌ No tener beneficios clínicos
⚠️ Generar daño
💰 Malgastar recursos
🌍 Afectar negativamente al medio ambiente
El informe propone una definición amplia e innovadora que incluye:
– Uso excesivo/inapropiado (ej: pruebas innecesarias)
– Uso insuficiente (ej: falta de servicios necesarios)
– Variaciones injustificadas (ej: diferencias entre regiones sin razón médica)
El grupo de expertos de la Comisión Europea establece un nuevo marco conceptual con nueve definiciones o tipos de prácticas de bajo valor (PBV), clasificadas en tres grandes categorías:
– Uso excesivo o inapropiado (5 tipos de PBV): incluye intervenciones sin beneficio demostrado y aquellas con alternativas más costo-efectivas o que se realizan en niveles asistenciales innecesariamente costosos.
– Uso insuficiente (2 tipos de PBV): se refiere a servicios necesarios que no se ofrecen o no se utilizan, lo que compromete los resultados en salud.
– Variaciones injustificadas (2 tipos de PBV): son las diferencias geográficas o entre grupos poblacionales que no se explican por necesidades clínicas y que pueden reflejar tanto sobreutilización como infrautilización.

Ejemplos de prácticas de bajo valor:
💊 Uso excesivo de antibióticos
🦴 Radiografías tempranas sin necesidad
🧴 Niveles de vitamina D en personas sanas
👵 Medicación inapropiada en mayores
🏥 Hospitalizaciones evitables
📌 Recomendaciones clave:
📚 Guiarse por evidencia y crear herramientas de decisión.
🏗️ Reorganizar servicios.
📈 Medir resultados y dar retroalimentación.
📣 Informar y sensibilizar a pacientes y profesionales.
🌱 Ampliar el concepto de “valor”: salud, equidad y sostenibilidad.
🌍 Ejemplo inspirador en España es la iniciativa “No Hacer”.
La reducción de prácticas de atención de bajo valor no solo optimiza la eficiencia del sistema de salud y minimiza el riesgo de daño evitable en los pacientes, sino que también constituye una oportunidad estratégica para reorientar recursos hacia intervenciones de alto valor. Esta transición favorece la equidad en el acceso, disminuye la huella ambiental del sistema sanitario y contribuye a su sostenibilidad a largo plazo. La integración de su medición en los procesos de evaluación del desempeño es esencial para consolidar un modelo de atención verdaderamente orientado al valor.
✅ Reducir la atención de bajo valor = + salud + equidad + eficiencia + sostenibilidad
¡Una prioridad para los sistemas sanitarios del futuro! 🚀🌿
Pues todo esto viene a raíz de una de las categorías. En concreto, es una denominada de la categoría “Uso excesivo o inapropiado”, que incluye intervenciones más costoefectivas o sostenibles. Pues aparece con la letra D, que es el “Uso de material médico único cuando se podría reutilizar en múltiples usos”, y he buscado el original en el Informe (página 17 y 20):

“Single-use medical material that could be sterilised for multiple use”, que puede traducirse como “Material médico de un solo uso que podría esterilizarse para usos múltiples”. Y este es un tema del que hemos hablado y discutido demasiado en este Blog. Los dispositivos de un solo uso son de un solo uso, y no se pueden reesterilizar porque lo prohíbe la normativa vigente (Real Decreto 192/2023) y para mantener la seguridad de nuestros pacientes.
Creo que lo correcto sería escribir: Es preferible utilizar material médico reutilizable seguro, en lugar de productos de un solo uso.

https://doi.org/10.1016/S0140-6736(25)01099-2
Aprovecho para traeros este artículo de Kremer (Sobieski, W., Kremer, T., Tortora, A., Rodriguez, C., Rauber, J., Znamensky, D., Todd, A., & McDonnell, G. (2025). Processing Reusable Medical Devices and End-of-Life Investigation. Biomedical instrumentation & technology, 59(2), 136–144. https://doi.org/10.2345/0899-8205-59.2.136), que no lo puedo poner en abierto. Que viene a decirnos que los productos sanitarios reutilizables están destinados a ser sometidos a múltiples ciclos de procesamiento clínico a lo largo de su vida útil, de conformidad con las instrucciones de uso del fabricante (IFU). De ahí la importancia económica y medioambiental de utilizar productos reutilizables y no de un solo uso. Las IFU deben incluir información práctica sobre la vida útil del producto sanitario. En este estudio de Kremer de laboratorio se investigó un enfoque para respaldar una vida útil indefinida de los dispositivos reutilizables (¡obsolescencia programada en la central!), en el que el final de la vida útil depende de la inspección visual y la verificación funcional proporcionadas en las IFU. Los dispositivos se sometieron a ciclos repetitivos de procesamiento (limpieza, desinfección y esterilización). En distintas fases del estudio, se examinaron los defectos visuales de los dispositivos a lo largo del tiempo. Además, se evaluaron los niveles extraídos de carbono orgánico total y citotoxicidad.
Los resultados indicaron que los efectos de los ciclos repetidos de procesado en el dispositivo ensayado fueron insignificantes en cuanto a daños físicos y niveles químicos residuales. Estos resultados apoyan una vida útil indefinida del dispositivo utilizando las indicaciones de fin de vida útil, basadas en la IFU y los requisitos de inspección (limpieza, daños y funcionamiento correcto).
De este artículo (George RE, Bay CC, Shaffrey EC, Wirth PJ, Rao VK. A Day in the Life of a Surgical Instrument: The Cycle of Sterilization. Ann Surg Open. 2024 Feb 22;5(1):e381. doi: 10.1097/AS9.0000000000000381. PMID: 38883953; PMCID: PMC11175864) se obtienen algunas conclusiones:
- El costo de esterilización por instrumento varía entre USD $0.59 y $11.52.
- Sólo se utiliza entre el 13% y el 22% de los instrumentos incluidos en bandejas estándar.
- La vida útil típica de un instrumento oscila entre 300 y 900 ciclos de esterilización, aunque no suele llevarse un registro individual.
- Optimizar el tamaño de las bandejas puede reducir hasta un 70% la esterilización innecesaria, ahorrando millones de dólares anuales sin afectar los tiempos quirúrgicos.
- Con un mejor diseño de bandejas, registro de ciclos y conciencia del personal quirúrgico, es posible aumentar la eficiencia, prolongar la vida útil de los instrumentos y reducir gastos sin comprometer la calidad asistencial.
- Reducción del procesamiento redundante para aumentar la vida útil de los instrumentos y disminuir costos.
- El proceso de esterilización quirúrgica es complejo, esencial para la seguridad y con un fuerte impacto económico.
Entrada realizada con la ayuda de: https://sano-y-salvo.blogspot.com/2025/08/la-identificacion-medicion-y-reduccion.html?m=1&s=09
La Sociedad Española de Desinfección y Esterilización (SEDE) lanza un nuevo episodio de su espacio “SEDE Opina”, un podcast dedicado a compartir conocimiento, experiencias y buenas prácticas sobre desinfección, esterilización y prevención de infecciones relacionadas con la asistencia sanitaria.
En este formato ágil y cercano, nuestros especialistas analizan los retos actuales en la seguridad del paciente, la gestión de centrales de esterilización y la implantación de normas internacionales (ISO 13485, ISO 17665, ISO 15883) en los entornos hospitalarios.
🎧 Escúchalo aquí: https://lnkd.in/dbTrzKrM
🔗 Descubre cómo la innovación y la formación continua fortalecen la calidad asistencial.
Ya sé que esta entrada no es de las habituales de esterilización, con sus Bowie-Dick o los sistemas de envasado, pero creo que la profesionalización de las centrales pasa por incluir más temas de gestión.
Aunque para presentar alimentos, nadie mejor que Lolo Torosio, qué arte presentando unos huevos fritos con pisto o unos churros. Dan ganas de comérselos.
Y después de ponernos bien de comer, un poco de leche de coco. Casi me da vergüenza ajena ver el vídeo. No hay desperdicio por ningún sitio: los bailarines con pelo en pecho, la bailarina con esa especie de moño y el solista al más puro Demis Roussos.

Enlace: https://forms.office.com/e/86XFaF2kEv

El “Máster en Reprocesamiento de productos sanitarios” permitirá a los profesionales que dirijan Centrales de Esterilización que profundicen su formación a través de la adquisición de un avanzado nivel de conocimientos teóricos, técnicos y metodológicos en el área del reprocesamiento de productos sanitarios; brindándoles las herramientas científicas y prácticas para desarrollarse como especialistas en éste ámbito.
El programa está dividido en 3 módulos, cada uno de los cuales incluye una parte de formación y una parte de evaluación.
Los módulos deberán consultarse en el orden predeterminado, y sólo se podrá avanzar al siguiente módulo si la evaluación del módulo anterior es satisfactoria.
El Máster es totalmente online, tiene una duración de 10 meses y el coste total es de 2.250 euros.
Recuerda que las plazas son limitadas.
Para obtener más información o resolver tus dudas sobre el máster, puedes contactar con masterrpseuneiz@gmail.com o llamando al teléfono de la Universidad de Vitoria-Gasteiz (EUNEIZ): +34 637 844 471.
¡Esperamos verte en el Máster!
Estudio sobre «Reprocesado de materiales sanitarios en punto de uso de centros sanitarios españoles»
Estudio voluntario y anónimo, dirigido a los profesionales (enfermeras, TCAE, higienistas dentales, tatuadores, odontólogos, etc), que reprocesan materiales sanitarios en punto de uso, de centros sanitarios españoles. El objetivo de este estudio es describir las prácticas de reprocesado de productos sanitarios en punto de uso de centros sanitarios de España y analizar su grado de adecuación a los estándares recomendados.

Enlace: https://forms.office.com/e/86XFaF2kEv
Gracias por su colaboración en la difusión del cuestionario a los profesionales de sus áreas de salud que reprocesan materiales sanitarios en punto de uso.

Investigadores:
Dra. Emiliana de los Ángeles Sabuco Tébar. https://orcid.org/0000-0002-1872-7094
Dr. Juan José Criado Álvarez. http://orcid.org/0000-0002-7733-9788
Lista de Control o Check-list prequirúrgico
Creo que alguna amiga mía va divulgando una frase mía muy divertida:
«Quiere el instrumental en un nanosegundo en el metaverso»

Se trata de un problema que tenemos en todos los centros sanitarios, el bloque quirúrgico necesita rápidamente el instrumental para salvar vidas, disminuir la espera quirúrgica, evitar infecciones relacionadas con la asistencia sanitaria… y en la central de esterilización necesitan de un tiempo para reprocesar el material, cumplir unas normas y estándares. Todo ello provocado en parte por un déficit endémico de instrumental.
¿Os imagináis poder preparar todo el instrumental necesario con el suficiente tiempo antes de la intervención programada? ¿Y si os digo 48 horas?
Pues eso lo han hecho en la HAS (Haute Autorité Sanitaire). Y es que se ha visto que el 25% de los eventos adversos producidos en Francia están relacionados con los dispositivos médicos; y es que un 30% no están disponibles cuando hacen falta, no funcionan o no están estériles entre otros problemas. ¡¡Tenemos un problema!!
Aquí tenéis los enlaces:
- Lista de Control o Check list
- Documento «Check list antes de las 48 horas»
Para una política de seguridad y calidad en el bloque quirúrgico, necesitamos unos prerrequisitos (que no sé si los cumplimos en España):
- Pasar de las hojas de programación y las órdenes escritas a mano a un sistema informatizado completo.
- Promover un soporte único de difusión de la información y un sistema para compartirla entre todos los actores (cirujano, quirófano, farmacia, fabricantes).
- Obtener de los fabricantes la posibilidad de proporcionar rápidamente material en préstamo cuando falte material, idealmente en menos de una semana. Idealmente en menos de 48 horas (72 horas para las operaciones de los lunes).
- Establecer una lista de implantes con un sistema de alerta automática en caso de escasez o desabastecimiento.
- Definir los responsables de la realización de la lista de comprobación «equipamiento 48 horas antes de cualquier operación programada» (instrumentista, esterilización, recursos materiales…).
- Informar sistemáticamente al cirujano después de la realización del check-list o lista de control.
horas antes de cualquier operación programada» en soportes claramente identificados. - Incluir la lista de comprobación en la historia clínica del paciente, junto con la lista de comprobación «seguridad del paciente en el quirófano».
No sé si lo veré implantado en España, y si se hace, que se haga bien y no de una manera rutinaria y monótona como la lista de comprobación quirúrgica. Y es que en Francia tienen lo que denominan «No Go«, que quiere decir «arrêt immédiat et imprévu de l’acte chirurgical au bloc opératoire avant l’incision cutanée» (interrupción inmediata e imprevista del acto quirúrgico en el bloque quirúrgico antes de la incisión de la piel) (En el enlace hay un informe muy interesante).

También han creado POur-DECider (y dejan un ejemplo). Donde:
POur: es el proceso previo de reflexión. P: Problema. Ou: Opciones o soluciones útiles. R: Riesgos
– : El propio guión es el tiempo de intercambio entre personas o equipos
DEcider: es el proceso de decisión y solución encontrada. D: Decisión, qué hacemos. E: ejecución, qué se hace, cuándo y cómo. Cider: Control de lo ejecutado, y si se ha hecho bien
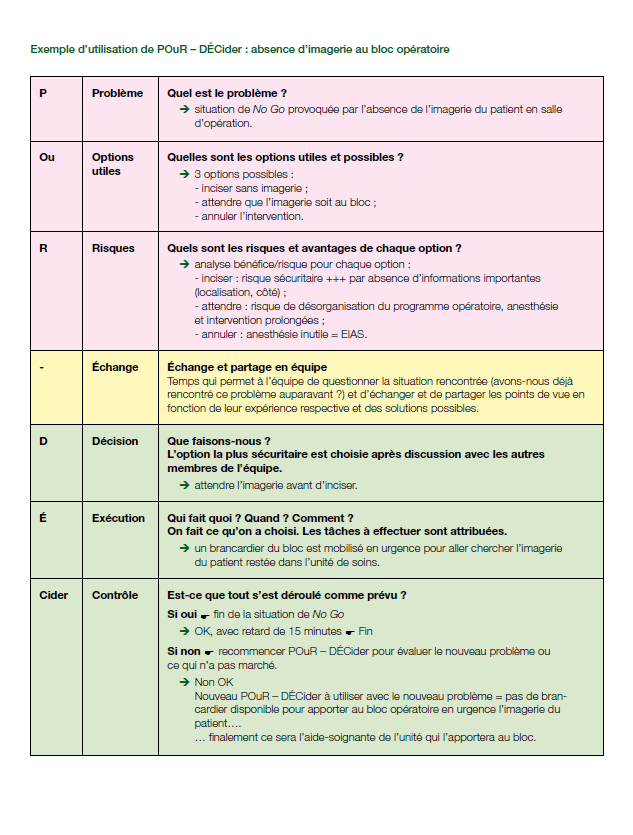
En unos días nos vemos en Oviedo. No dejéis de consultar el programa.


Lo dicho en esta entrada es sencillamente gestión de riesgos, control de calidad, seguridad del paciente, y ahora a los gestores hay que añadirles la palabra humanización (no sé qué más veré y escucharé en mi vida laboral). Creo que va por modas. En 1994 empezamos con la Medicina Basada en la Evidencia y la epidemiología clínica, luego todo fue Control de Calidad (1996), para pasar a Seguridad del paciente (1998) y finalizar en la Gestión de Riesgos (2000). Todo mi currículum es un reguero de cursos y seminarios sobre estos temas. Y ahora ha llegado la humanización. Pues yo para humanizar este blog uso música de despedida, mezclando «petardeo» y algo un poco más serio. Vamos a ver si sois capaces de diferenciarlas en esta selección. ¡¡Viva el verano!!
Manual de reprocesado de material del sultanato de Omán
Es correcto, han leído bien. Hoy les traigo el manual o guía de reprocesado de material del Sultanato de Omán. He tenido que repasar mi geografía de la EGB para recordar dónde está y cuál es su capital.
En este link tenéis la Guía (en inglés) [Actualización: Parece que me han cambiado el enlace. Lo intento solucionar]
¿Qué puedo destacar de esta Guía? Son 162 páginas muy bien estructuradas, está escrita con claridad y está actualizada.
En el capítulo 1 revisan toda la arquitectura y normas ambientales de la central (algo que falta en muchas guías), y en el capítulo 2 tenemos el apartado de formación y número de personas que deben trabajar (pero no lo veo muy claro según mi experiencia).
El capítulo 3 es el más extenso, y en él se tratan todos los temas que más nos interesan. En la página 66 se especifican los indicadores a utilizar, y en Omán si que recomiendan los biológicos de forma diaria, o al menos una vez a la semana (interesante la tabla 8 de la página 75). Y siempre que haya implantes o si se usa óxido de etileno (página 71). En Omán se usa óxido de etileno, formaldehído, y todos los sistemas de peróxido de hidrógeno.
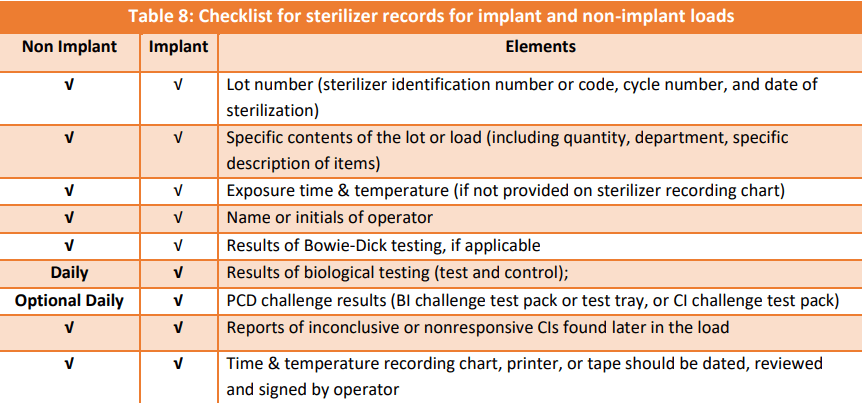
Muy interesante todo lo relativo a la calidad del agua y del vapor de agua que se usa (Anexo D y E). Ahora que tenemos que hacer gestión de riesgos en las centrales según el nuevo real decreto, no nos viene mal leer la página 85 y el capítulo 5, que es un mix de cosas:
- Productos de un solo uso (página 95).
- Cajas húmedas (página 96).
- Fallos de esterilización (página 97).
Luego vienen una serie de capítulos, como es la esterilización en atención primaria (el número 7), endoscopia (capítulo 8 y el Anexo B que es muy bueno).
Es una guía que puede resultar útil como complemento a las que ya tenemos en nuestro recopilatorio. Desde luego, la parte de la calidad del agua y del vapor es la más importante.
No he encontrado música de ese país ni ningún hit parade. Así que pondré música de la mía de los años 70-80.
Y un guiño al congreso de la SEMPSPGS de Pamplona.













Debe estar conectado para enviar un comentario.