La APIC (Association for Professionals in Infection Control and Epidemiology) ha presentado un informe ejecutivo sobre el control de los endoscopios, con la participación de Olympus.
La endoscopia está avanzando y prueba de ello son las diferentes entradas de este Blog:
- Lectura crítica de la Guía AKI de endoscopios
- Protección para endoscopios
- Guía AKI sobre tratamiento de endoscopios
- Novedades y avances en el control de endoscopios
- Envasado y almacenamiento de endoscopios
- Lavadoras desinfectadoras y … esterilizadoras de endoscopios
- ¿Qué lavadora de endoscopios me compro?
- Presentación del VII Congreso de la SAMPSPGS: «La ruleta de la desinfección» y la necesidad de la esterilización de endoscopios, el control del agua y las manchas del instrumental
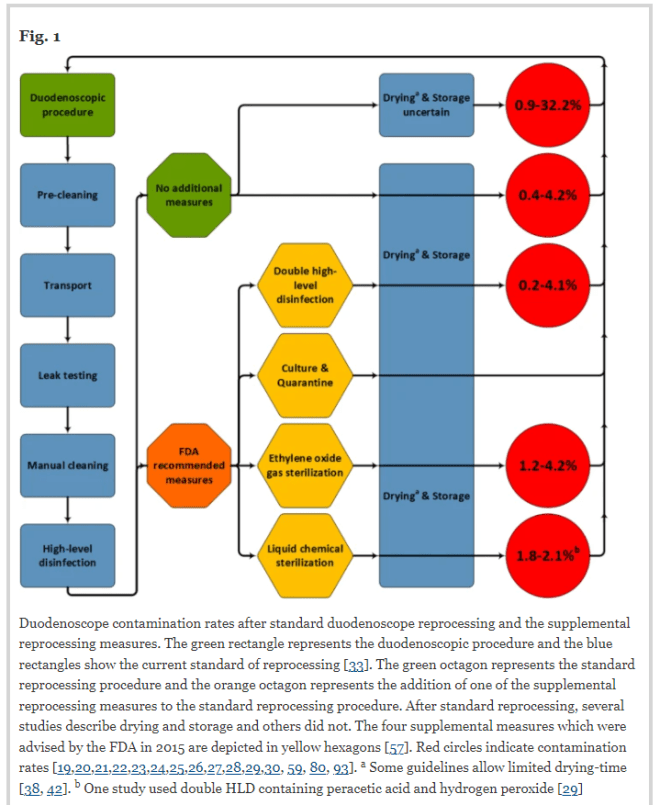
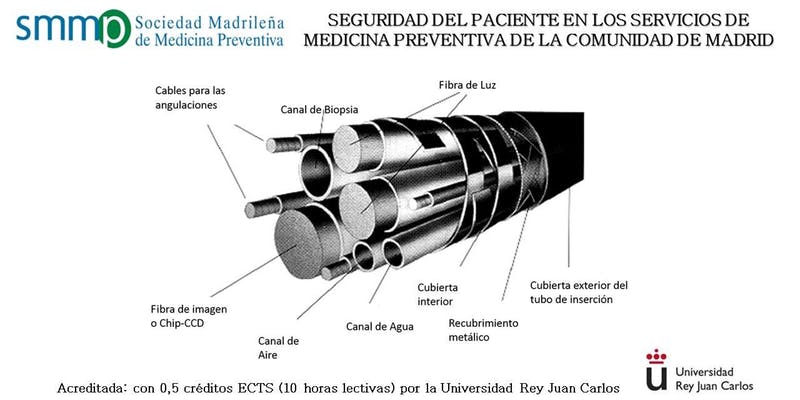
El reprocesamiento de endoscopios implica múltiples pasos clave, y cualquier paso o error que se pase por alto puede provocar incidentes de seguridad. Cada paso del proceso tiene riesgos potenciales y puntos de fallo. El personal sanitario debe conocer la justificación de cada paso del proceso y los riesgos asociados a su incumplimiento. Este documento pretende ser un recurso para explicar de forma sucinta los requisitos y recomendaciones basados en la evidencia, los requisitos normativos, las mejores prácticas y las cuestiones controvertidas en el reprocesamiento de endoscopios. En el siglo XXI, el endoscopio se ha convertido en una herramienta diagnóstica y terapéutica inestimable para realizar procedimientos mínimamente invasivos destinados a examinar el tracto gastrointestinal, los pulmones, el tracto urinario, la faringe, la cavidad abdominal y la nariz. La construcción y el diseño complejos de algunos endoscopios pueden plantear problemas de reprocesamiento debido a los múltiples canales, los lúmenes estrechos y otras características especiales como la zona del elevador del duodenoscopio. En 2015, los Centros para el Control y la Prevención de Enfermedades (CDC) solicitaron al Comité Asesor de Prácticas de Control de Infecciones Sanitarias (HICPAC) que elevara los estándares en las instalaciones para mejorar la infraestructura y la gestión de los programas de reprocesamiento de endoscopia. Desde entonces, múltiples organizaciones, como la Asociación para el Avance de la Instrucción Médica (AAMI), la Asociación de Enfermeras Registradas Perioperatorias (AORN) y la Sociedad de Enfermeras y Asociados de Gastroenterología, Inc. (SGNA), han publicado directrices nacionales dedicadas a la investigación y los avances actuales en el reprocesamiento de endoscopios flexibles específicos para estos pasos clave del proceso. En este informe se presenta un panorama científico de los fundamentos de los pasos clave del proceso y los riesgos asociados con el incumplimiento en el reprocesamiento de endoscopios que pueden dar lugar a eventos de seguridad del paciente, además de varios temas controvertidos que justifican una mayor investigación para fortalecer las prácticas basadas en la evidencia y los requisitos reglamentarios. La mejora de la seguridad del paciente en endoscopia es multifactorial, y los esfuerzos futuros para estandarizar materiales y protocolos pueden disminuir las variaciones en la práctica.
Y aquí una historia de una apuesta colonoscópica: 🎭 Título: «El Gran Colonoscopio Galés»
🎬 La historia comienza con una apuesta ridícula: Rob McElhenney reta a Ryan Reynolds a aprender galés. ¿El castigo para el perdedor? ¡Una colonoscopia grabada! Porque claro, eso es lo más lógico después de perder en Duolingo.
🏥 Preparación al estilo Hollywood: Ryan describe el proceso de laxantes como “más acción que en cualquier peli de Marvel”. Spoiler: no hay escena post-créditos, solo post-excrementos.
📺 Momento educativo, pero con chistes de traseros: Mientras le meten la cámara, los doctores están calmados… y Ryan también, aunque probablemente con ayuda de algún sedante que podría venderse como “Deadpool Calm”.
😳 Reacción al descubrir pólipos: Cuando encuentran uno, Ryan dice algo como “¿es esto un récord del Guinness?”. Luego encuentran otro y Rob casi salta de alegría como si fuera un premio en un juego de feria.
🎯 Rob también cumple: Aunque perdió Ryan, Rob decidió hacer la prueba también. ¿Su comentario al respecto? “No puedo quedarme sin cámara en mi trasero si Ryan ya fue trending topic por el suyo.”
🧻 El emoji: Aunque no lo muestra literalmente, la cara de Ryan cuando le cuentan lo de los pólipos es básicamente el emoji del mono que se tapa los ojos 🐵, seguido de 💩 y luego 🎉 (porque todo salió bien).
Los puntos clave de la Guía APIC son:
- La guía destaca la importancia de cada paso en el reprocesamiento de endoscopios, enfatizando que omitir o cometer errores en cualquier paso puede resultar en incidentes de seguridad. El personal sanitario debe conocer la lógica de cada paso del proceso y los riesgos asociados al incumplimiento.
- El documento sirve como un recurso para explicar de forma resumida los requisitos y recomendaciones basados en la evidencia, los requisitos normativos, las mejores prácticas y los temas controvertidos en el reprocesamiento de endoscopios.
- El uso de equipo de protección personal (EPI) es fundamental para proteger al personal sanitario y prevenir la propagación de infecciones entre los pacientes.
- La guía también aborda consideraciones generales como la documentación y el aseguramiento de la calidad, así como pasos específicos del proceso como la limpieza previa en el punto de uso, la prueba de fugas, la limpieza manual, la inspección y la verificación de la limpieza, la desinfección o esterilización de alto nivel, el secado y el almacenamiento y transporte.

Y ofrece recomendaciones específicas para garantizar la seguridad y la eficacia en el reprocesamiento de endoscopios:
- Limpieza inicial inmediata: Tras finalizar el procedimiento, se debe succionar una solución con detergente enzimático a través del canal de aspiración durante 10-15 segundos para eliminar restos de sangre o moco.
- Desmontaje y limpieza manual: Se deben retirar válvulas y tapones de los canales del endoscopio antes de sumergirlo en una solución con detergente enzimático. La limpieza debe incluir el uso de esponjas, gasas y cepillos suaves diseñados específicamente para los canales del endoscopio. Es esencial realizar esta limpieza manual al menos tres veces por canal. Se promueve el uso de sistemas automatizados de reprocesamiento de endoscopios.
- Evitar ciertos productos químicos: No se deben usar detergentes con aldehídos ni espumosos en esta etapa, ya que pueden fijar proteínas o dificultar la visualización de residuos. Los detergentes enzimáticos deben desecharse tras cada uso porque no tienen acción microbicida.
- Inspección y pruebas de estanqueidad: Al finalizar la limpieza, se recomienda inspeccionar el endoscopio y realizar pruebas de estanqueidad para detectar posibles daños que puedan ser focos de contaminación o causar fallos técnicos.
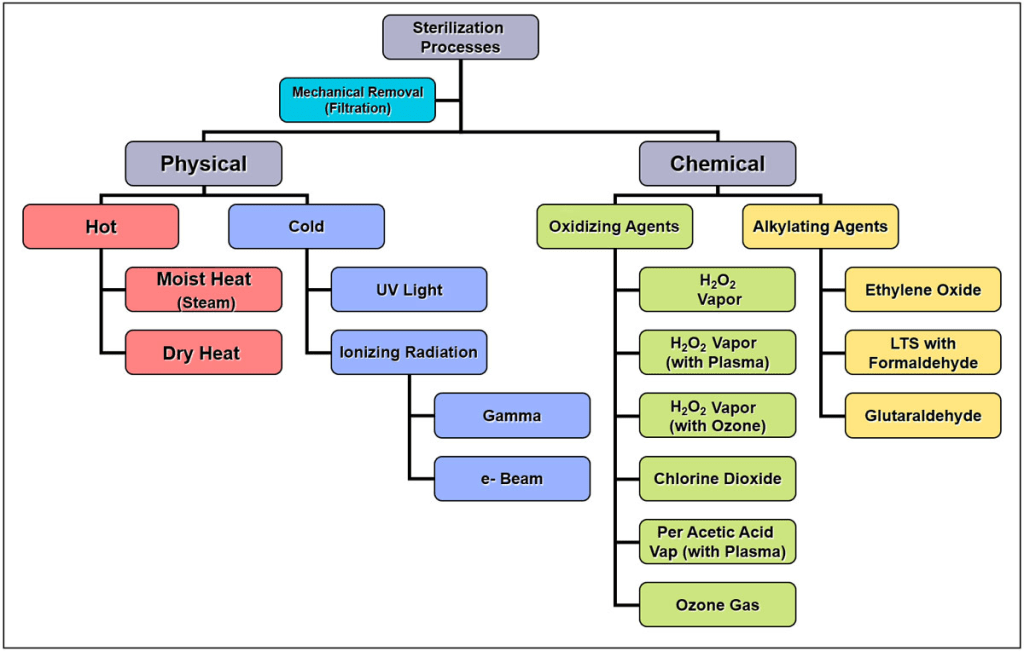
- Desinfección de alto nivel o esterilización: Dado que los endoscopios son considerados material semicrítico, se requiere desinfección de alto nivel o esterilización cuando sea posible. En caso de componentes no esterilizables, se sugiere el uso de material desechable. Se ha introducido un paso de secado más riguroso después de la desinfección de alto nivel, que incluye el purgar los canales con aire comprimido, lavar los canales con alcohol y secar con aire forzado durante al menos 10 minutos.
- Uso de equipo exclusivo para pacientes con enfermedades específicas: Para patologías como la enfermedad por priones (vECJ), se recomienda usar equipos exclusivos o evitar procedimientos endoscópicos si no son imprescindibles. Quizás en estos casos convenga recordar que existen los dispositivos de un solo uso:
- Desafíos del reprocesado de endoscopios reutilizables (I). Repercusiones ambientales: Potenciales soluciones
- Desafíos del reprocesado de endoscopios reutilizables (II). Contaminación cruzada asociada a dispositivos de endoscopia y consecuencias clínicas para los pacientes
- Desafíos del reprocesado de endoscopios reutilizables (III). Reutilización de dispositivos de endoscopia de un solo uso. ¿Qué consecuencias médicas puede acarrear?
- Desafíos del reprocesado de endoscopios reutilizables (IV). Análisis económico sobre reutilización de dispositivos de endoscopia de un solo uso

- Uso de equipo exclusivo para pacientes con enfermedades específicas: Para patologías como la enfermedad por priones (vECJ), se recomienda usar equipos exclusivos o evitar procedimientos endoscópicos si no son imprescindibles. Quizás en estos casos convenga recordar que existen los dispositivos de un solo uso:
Estas medidas buscan minimizar riesgos infecciosos tanto para los pacientes como para el personal sanitario.
Los endoscopios en el Top Ten de Riesgos.

También presentan un Check-List en español por si os animáis a hacer auditorías e inspecciones en vuestras unidades de endoscopia. Además de una ayuda visual.


Y, como es habitual, una despedida musical.
¡Ay, el muñeco!

Y que no nos falte el humor. Este caballero se dejó engañar, se me rompe el alma:































































Debe estar conectado para enviar un comentario.