Hace un tiempo escribí una entrada sobre La desinfección de transductores de ecografía. Es un tema al que no se presta demasiada importancia (al menos en España), pero que por su relevancia e importancia para la seguridad del paciente debemos atender desde los Servicios de Medicina Preventiva. Esa entrada tiene toda la información epidemiológica y clínica de por qué hay que cuidar los transductores ecográficos; hoy aquí solo vamos a hablar de la nueva Guía que ha salido.
Voy a resumir con la ayuda de ChatGPT la «Declaración oficial de AIUM: Directrices para la limpieza y preparación de los transductores y equipos de ultrasonidos de uso externo e interno entre pacientes, así como para la manipulación y el uso seguros del gel de acoplamiento de ultrasonidos, Revisión 2025», que acaba de salir publicada.
Aquí tienes un resumen claro y completo del documento titulado AIUM Official Statement: “Guidelines for Cleaning and Preparing External- and Internal-Use Ultrasound Transducers and Equipment Between Patients as Well as Safe Handling and Use of Ultrasound Coupling Gel, 2025 Revision”.
🔍 Resumen general
El documento establece normas actualizadas de limpieza, desinfección y manejo seguro para transductores ecográficos (internos y externos), el equipo relacionado y el gel de acoplamiento, con el fin de prevenir infecciones cruzadas y proteger tanto a pacientes como a trabajadores de la salud.
✅ Ideas principales por secciones
1. Limpieza y preparación de transductores
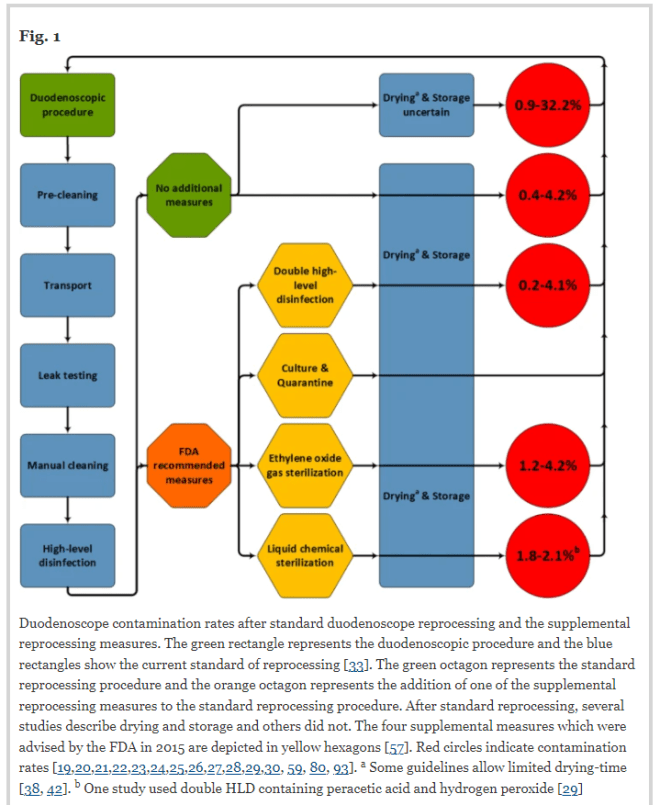
- Transductores externos (contacto con piel intacta): requieren desinfección de bajo nivel (LLD) entre pacientes.
- Transductores internos (uso endocavitario): requieren desinfección de alto nivel (HLD) obligatoria y cubiertas protectoras de uso único y alta calidad.
- Procedimientos percutáneos: se deben usar transductores con cubiertas estériles de un solo uso y realizar LLD.
- Proceso de limpieza:
- Retirar gel y residuos.
- Lavar con jabón suave.
- Aplicar desinfectante (LLD o HLD según corresponda).
- Enjuagar con agua potable.
- Secar completamente.
- Almacenar correctamente.
🛑 No seguir las instrucciones del fabricante puede dañar el transductor y comprometer el diagnóstico.
2. Literatura reciente y directrices relevantes
- Estudios muestran contaminación persistente con virus (ej. VPH) incluso con uso de fundas protectoras.
- Se destaca la importancia de realizar HLD en transductores endocavitarios.
- Falta de formación del personal en protocolos de limpieza es un problema recurrente.
- Casos documentados de infecciones nosocomiales por fallos en limpieza o daño mecánico de transductores.
3. Uso seguro del gel
- Gel estéril de un solo uso recomendado en:
- Procedimientos invasivos.
- Exámenes a neonatos.
- Contacto con piel no intacta o quirúrgica reciente.
- Gel no estéril:
- Puede usarse en procedimientos estándar.
- Evitar contacto del pico del envase con superficies.
- No reutilizar envases.
- Calentamiento del gel: solo con calor seco; limpiar el calentador regularmente.
4. Manejo seguro del equipo ecográfico
- Limpiar regularmente consolas, cables, conectores, gel, camas, teclados, según protocolos institucionales.
- Se recomienda mayor frecuencia de limpieza cuando hay alto riesgo de contaminación (quirófanos, COVID-19, etc.).
- Muchos profesionales no limpian adecuadamente teclados ni cables, lo que incrementa el riesgo de infección.
5. Prevención de diagnósticos erróneos por equipos dañados
- Transductores defectuosos pueden producir:
- Imágenes de baja calidad.
- Errores en el Doppler.
- Diagnósticos incorrectos.
- Causas frecuentes:
- Uso de desinfectantes incompatibles.
- Sistemas de reprocesamiento no validados por el fabricante.
- Se debe:
- Revisar visualmente y funcionalmente el transductor antes de usarlo.
- Usar solo métodos aprobados por el fabricante.
🧪 Agentes desinfectantes comunes (HLD)
- Glutaraldehído
- Peróxido de hidrógeno
- Ácido peracético
- Orto-ftalaldehído
- Hipoclorito/Hipocloroso
- UV-C (luz ultravioleta germicida)
🌍 Consideraciones para entornos con recursos limitados
- Cuando no se dispone de desinfectantes:
- Usar agua potable y jabón (aunque no equivale a desinfección).
- Utilizar guantes o barreras físicas alternativas si no hay fundas.
- Seguir las directrices en la medida de lo posible y valorar riesgo/beneficio.
🏥 Recomendaciones específicas por tipo de examen y entorno clínico
👶 1. Exámenes neonatales
- Usar siempre gel estéril de un solo uso.
- Aplicar desinfección de bajo nivel (LLD) para transductores externos.
- El entorno neonatal requiere estricta higiene, debido a la inmunocomprometida condición del paciente.
- Evitar contaminación cruzada con un adecuado manejo del gel, equipo y transductores.
👩⚕️ 2. Exámenes endocavitarios (vaginales, rectales, transesofágicos)
- Los transductores son considerados dispositivos semicríticos:
- Obligatoria la desinfección de alto nivel (HLD) después de cada uso.
- Uso de fundas de transductor de un solo uso (idealmente con poros <30 nm para bloquear virus como VPH).
- No basta con cubrirlos: estudios demuestran presencia de HPV incluso tras el uso de fundas si no se desinfecta adecuadamente.
- Recomendaciones:
- Secar completamente el transductor antes del HLD.
- Utilizar desinfectantes compatibles aprobados por el fabricante.
🧪 3. Procedimientos intervencionistas percutáneos
(Ej. biopsias, colocación de vías centrales, toracocentesis, anestesia regional)
- Usar transductores con fundas estériles de un solo uso.
- Realizar limpieza con desinfección de bajo nivel (LLD) antes y después del procedimiento.
- Usar gel estéril en todos estos procedimientos.
- Ejemplos:
- Colocación de vías periféricas: funda no estéril aceptable.
- Biopsias o punciones: funda completamente estéril obligatoria.
🤰 4. Exámenes obstétricos (abdominales o transvaginales)
- Transductores abdominales (en piel intacta):
- Requieren solo LLD.
- Uso de gel estéril no es obligatorio, salvo que haya piel no intacta o infección.
- Transvaginales:
- Requieren HLD + funda de un solo uso.
- Uso de gel estéril o bacteriostático en mucosas.
🛏️ 5. Exámenes en quirófano o entorno quirúrgico
- Limpieza completa del escáner y accesorios antes de su ingreso al quirófano.
- Transductores deben usarse con cubiertas estériles y desinfectarse según su uso (LLD o HLD).
- Todos los componentes (cables, teclado, consola, cama) deben limpiarse antes y después del procedimiento.
- En caso de pacientes con riesgo elevado de infección (ej. COVID-19):
- Limpiar después del procedimiento para evitar contaminación cruzada.
🧴 Resumen

Estamos en plena ola de calor del mes de agosto, por eso la despedida musical va a ser muy veraniega, bailable y pegadiza. Ya vendrán épocas de más fresquito.
Un día tú, un día yo
Me quieres tú, te odio yo
Me odias tú, te quiero yo
Un dia tú, un día yo
El tema del verano «El cheque de La Makana», toda una oda a la poesía:




























































Debe estar conectado para enviar un comentario.